查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息
慢性肾病(CDK)是终末期肾病的主要病理表现,其中局灶节段性肾小球硬化症(FSGS)是导致CKD的主要病因之一,其特点是肾组织弥漫性肾小球硬化和肾小管间质病变。虽然已知包括免疫异常、基因突变和某些毒素在内的多种因素都会导致FSGS的发生发展,但FSGS发病机制仍未能完全阐明。已有的研究认为异常的T细胞活化在FSGS的发生发展中起着重要作用,但均未发现患者肾小球中有T细胞浸润。越来越多的证据表明,免疫细胞可通过释放外泌体参与到各种疾病中,且外泌体可包裹多种miRNA将它们递送至受体细胞来发挥作用。研究发现FSGS患者血浆miR-186-5p水平与蛋白尿水平呈正相关。然而,血浆中miR-186-5p的来源、是否会导致肾功能障碍及作用机制尚不清楚。
2023年7月3日,南京大学医学院刘志红院士团队在《Advanced Science》(IF=17.521)上发表了题为《CD8 T Cell-Derived Exosomal miR-186-5p Elicits Renal Inflammation via Activating Tubular TLR7/8 Signal Axis》的研究论文,证明了血浆循环中的miR-186-5p主要来源于活化的CD8 T细胞分泌的外泌体,它通过激活肾小管TLR7/8信号轴介导FSGS患者和阿霉素诱导肾损伤小鼠模型的肾功能障碍,这为治疗由T细胞介导的肾功能障碍提供了新的指导方向。值得注意的是,作者使用了汉恒生物提供的AAV-miR-186-5p sponge和AAV-TLR7 shRNA,成功敲低了小鼠血浆和肾脏中的miR-186-5p以及肾小管中的TLR7。
下面我们一起来看看作者是如何挖掘其中的机制:
作者之前的研究发现,血浆循环中的miR-186-5p可作为FSGS患者的生物标志物[1]。在这里,为了进一步探讨miR-186-5p在FSGS患者肾脏炎症和肾损伤中的作用,作者建立了阿霉素(ADR)诱导的肾损伤小鼠模型。结果发现与对照组小鼠相比,ADR处理小鼠的血浆以及循环T细胞中的miR-186-5p水平显著增加,且在CD8 T细胞中尤为明显(图1 A,B)。当使用CD8抗体消耗外周CD8 T细胞时,血浆miR-186-5p水平大大降低(图1 C)。这些结果与在FSGS患者中发现的类似,且支持CD8 T细胞是循环中miR-186-5p主要来源的观点。接着,在ADR处理小鼠的肾组织中也发现了与FSGS患者相似的结果,即肾脏表现出高水平的miR-186-5p,但miR-186-5p前体的表达水平没有变化(图1 D,E),表明小鼠模型和患者肾脏中的miR-186-5p升高并非来源于组织内部的表达,可能是来源于循环中活化的CD8 T细胞。为了探究循环中miR-186-5p升高是否会引起肾脏炎症和肾损伤,作者使用腺相关病毒(AAV)构建了AAV-miR-186-5p sponge,通过尾静脉注射感染小鼠,4周后发现,ADR处理小鼠的血浆和肾脏中miR-186-5p水平降低,并减轻了小鼠模型的肾小管损伤(图1 F,G)。此外,ADR处理小鼠的肾脏中浸润着大量的F4/80+CD11b+ 巨噬细胞和CD8 T细胞,敲低miR-186-5p后则可以显著减少这两种细胞的浸润(图1 H,I)。以上结果表明,miR-186-5p可能在ADR诱导小鼠引起肾脏炎症和肾损伤中发挥关键作用。
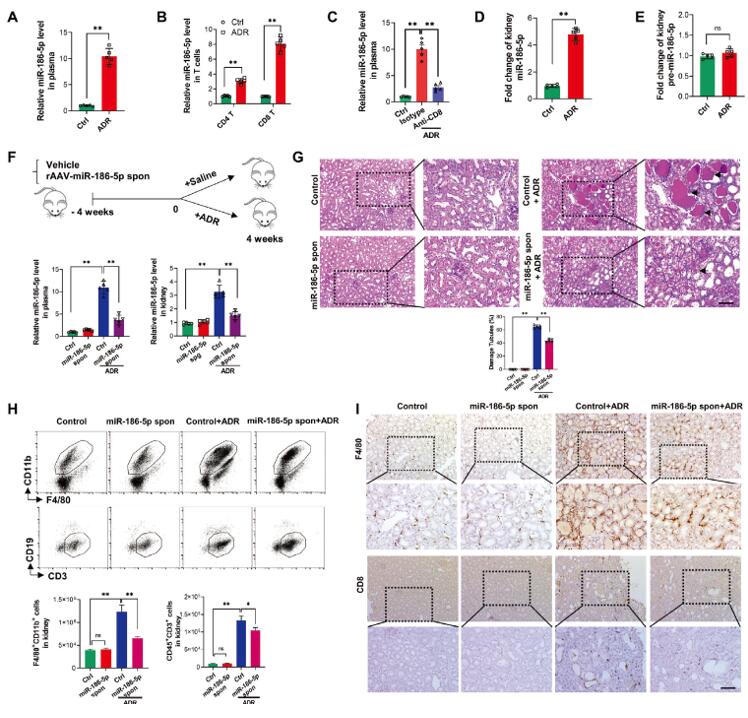
图1. 来源于肾脏外部的miR-186-5p在ADR小鼠模型中引发肾小管炎症和肾损伤
类似地,作者使用CD8 mAb抗体消耗CD8 T细胞,也显著减轻了ADR处理小鼠的肾脏炎症和肾损伤(图2)。
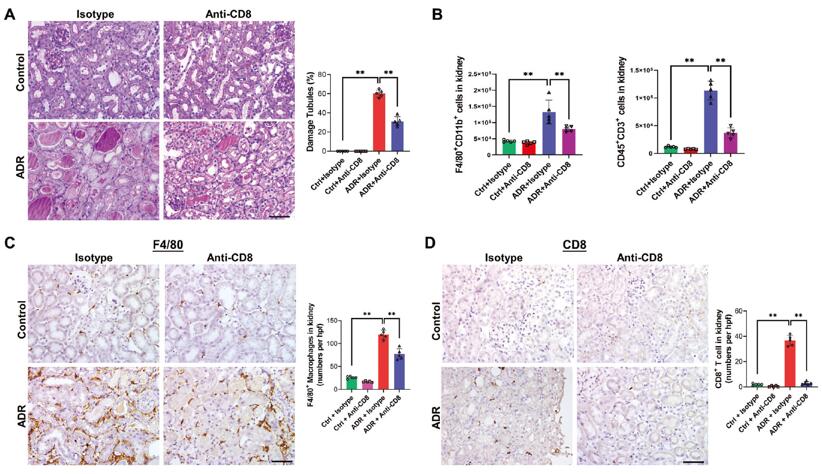
图2. 在ADR小鼠模型中,耗竭CD8 T细胞可减轻肾脏炎症和肾损伤
为了证实肾脏炎症和肾损伤中的miR-186-5p来源于循环CD8 T细胞。作者先从FSGS患者的外周血中分离出多种白细胞,包括CD19 B细胞、CD4 T细胞、CD8 T细胞、CD14单核细胞、CD16中性粒细胞和CD56 NK细胞,经检测发现CD8 T细胞中miR-186-5p的表达量最高,且血浆循环中的miR-186-5p被包裹在外泌体(EV)(图3 A,B),提示miR-186-5p是由EV介导其转运至肾脏中的。接着,作者发现FSGS患者外周血中T细胞源性EV(T-EV)显著多于健康人群,且其中含有较高水平的miR-186-5p(图3 C,D)。体外激活CD8 T细胞也得到了相同的结果(图3 E)。表明血浆循环中的miR-186-5p是包裹在T-EV中并由其介导转运。
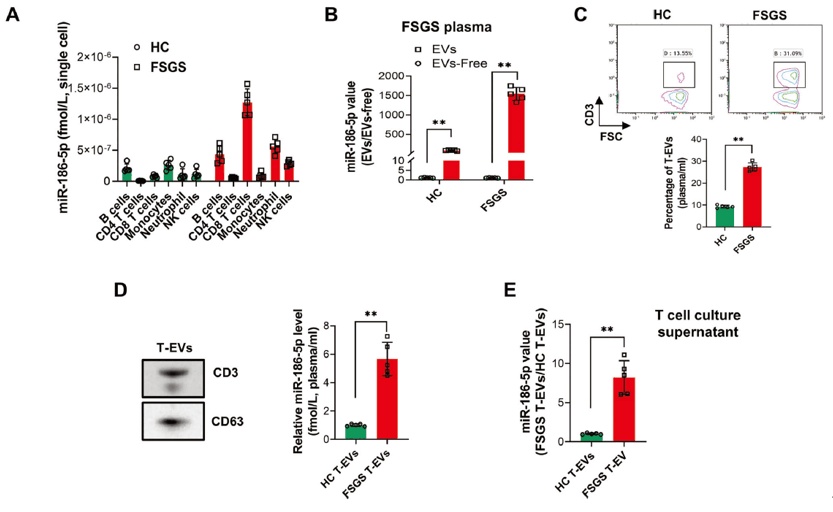
图3. 与健康志愿者相比,FSGS患者中循环CD8 T-EV含有更高水平的 miR-186-5p
紧接着,作者对miR-186-5p示踪以进一步研究CD8 T-EV能否进入肾组织。作者将Cy5标记的miR-186-5p转染至小鼠CD8 T细胞后,用CD3/CD28激活细胞,收集CD8 T-EV,用DiI(细胞膜红色荧光探针)将CD8 T-EV标记后经尾静脉注射至小鼠体内。注射3h后的DiI示踪结果显示,DiI标记的CD8 T-EV聚集在肾小管间质中,并且与一些巨噬细胞共定位,表明肾脏中浸润的巨噬细胞可能参与了CD8 T-EV的摄取并引发肾损伤和炎症(图4 A,B)。另外,为了检测肾脏炎症和肾损伤是否会促进CD8 T-EV的积累,作者检测了ADR处理小鼠肾脏中DiI标记的CD8 T-EV,与对照组小鼠相比,ADR处理小鼠的肾小管间质中的荧光信号更强,且荧光共定位和qPCR结果显示miR-186-5p-Cy5在近端肾小管细胞(PTC)中积累(图4 C-E)。
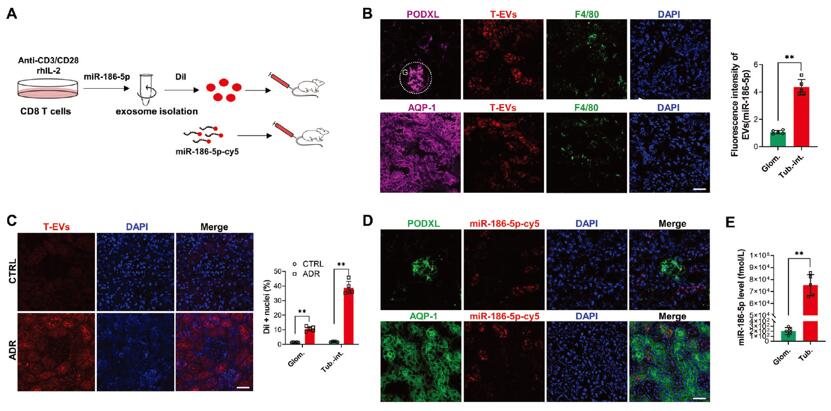
图4. T-EV将miR-186-5p从循环CD8 T细胞转移到肾小管间质
有研究表明,某些富含GU/UU序列的miRNA通过直接结合TLR7(小鼠)或TLR8(人)来促进先天免疫反应[2]。miR-186-5p就属于此类miRNA,因此作者假设miR-186-5p可能通过激活肾小管TLR7/8信号进而引发肾脏炎症。实验证实,miR-186-5p主要被转运到了TLR7/8高表达的肾小管细胞,且通过GU序列直接与TLR8结合(图5 A)。由于TLR8定位于内体中,经荧光共定位结果显示,HK2细胞中的TLR8同样定位于内体,并且miR-186-5p-Cy5也与TLR8共定位(图5 B)。
NF-κB是TLR8信号下游的转录因子,可调节TNF-α和IL-6等炎症因子的表达,二者可诱导PTC损伤[3]。NF-κB荧光素酶报告结果显示,miR-186-5p显著增加了NF-κB的活性,并上调了TNF-α和IL-6的表达,且miR-186-5p对于TNF-α和IL-6的表达具有时间和浓度依赖性;而TLR8抑制剂可以拮抗miR-186-5p这一作用(图5 C-E)。表明miR-186-5p确实可作为TLR8的配体激活炎症因子的表达。随后,作者发现使用NF-κB抑制剂雷公藤甲素可以显著阻断miR-186-5p诱导的炎症因子表达(图5 G)。与此相符的是,miR-186-5p会以时间依赖性促进HK2细胞凋亡。上述结果表明NF-κB通路参与了TLR8介导的炎症激活。
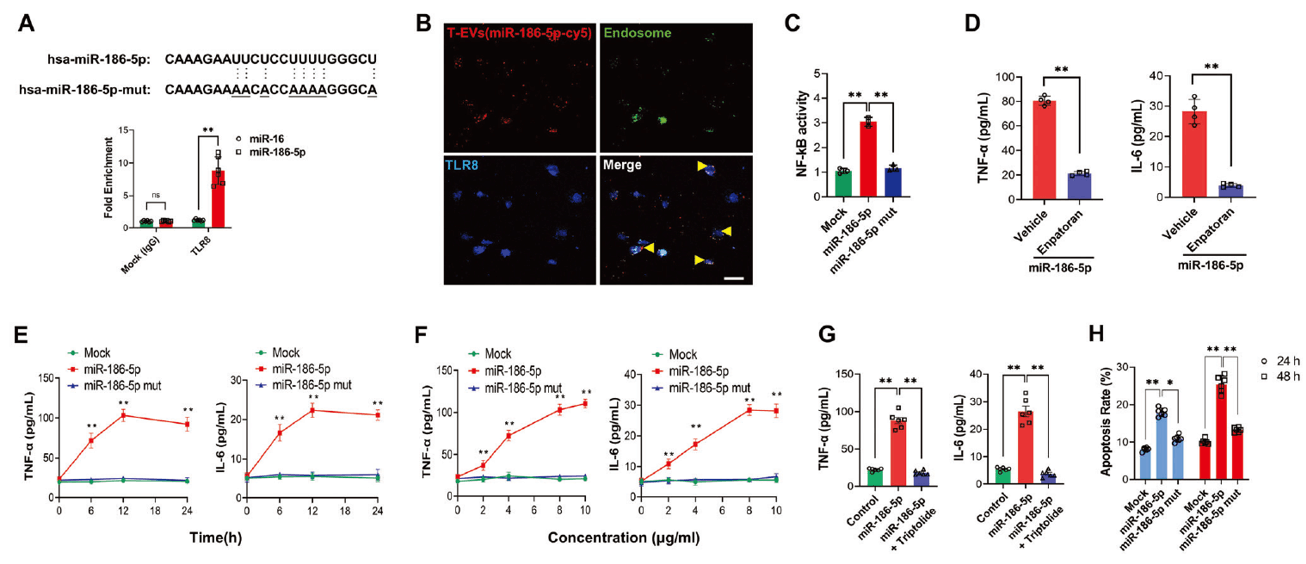
图5. 富含GU的miR-186-5p与内体TLR8结合并激活HK2细胞中TLR介导的炎症信号
为了进一步验证miR-186-5p通过激活肾小管细胞中的TLR7信号来引发小鼠肾脏炎症,作者直接给小鼠尾静脉注射合成的miR-186-5p、miR-186-5p-mut或生理盐水。结果显示,只有miR-186-5p注射组在小鼠肾组织中检测到miR-186-5p显著增加,肾小管损伤更严重,并且肌酐水平增加、F4/80+CD11b+巨噬细胞和CD8 T细胞浸润加剧、肾小管细胞中TLR7和NF-κB-p65表达水平显著增加(图6 A-F)。另外,miR-186-5p处理的HK2细胞中核内NF-κB-p65水平增加(图6 G)。以上结果表明,CD8 T-EV miR-186-5p可直接激活肾小管中TLR7/8信号。
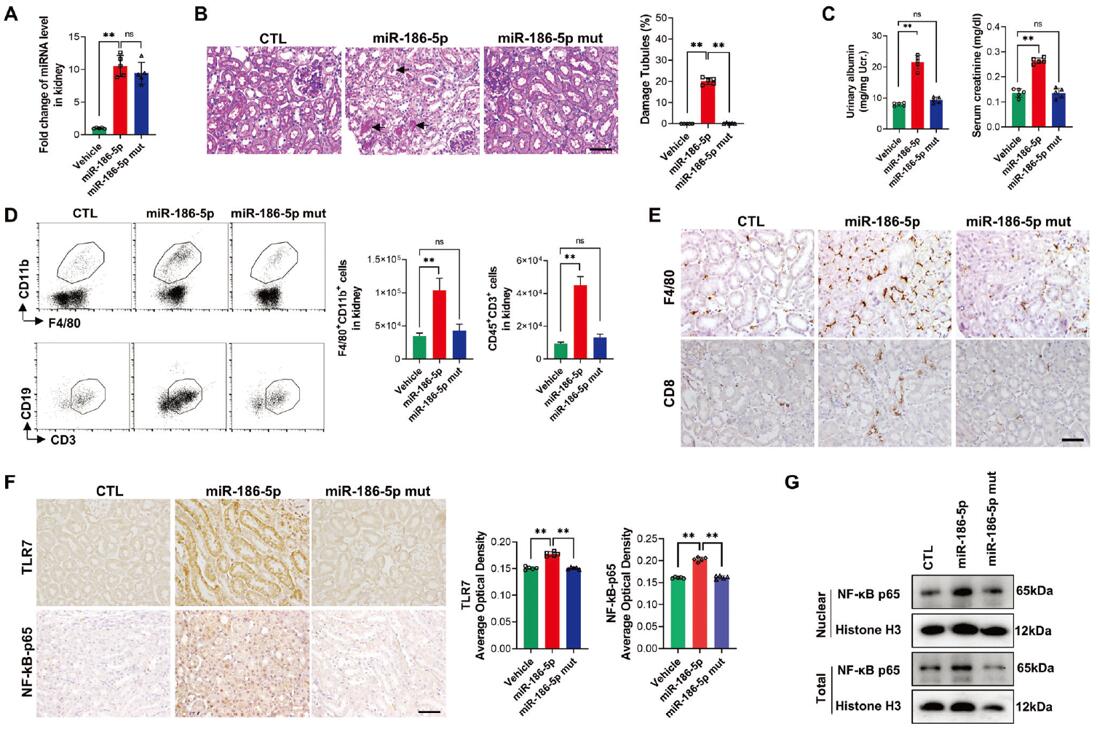
图6. 注射的miR-186-5p通过特异性激活肾小管TLR7信号进而引起小鼠肾脏炎症
为了探讨TLR7信号传导在miR-186-5p诱导肾损伤中的作用,作者构建了Tlr7-/-小鼠(图7 A),然后分别使用miR-186-5p或ADR处理Tlr7-/-小鼠,观察肾脏炎症和肾损伤情况。结果显示,用miR-186-5p或ADR处理的野生型小鼠表现出明显的肾小管细胞损伤;相反,同样处理的Tlr7-/-小鼠均未出现肾小管细胞损伤,F4/80+巨噬细胞、CD8 T细胞或CD45+CD3+T细胞的肾脏浸润也显著减少(图7 B-I)。
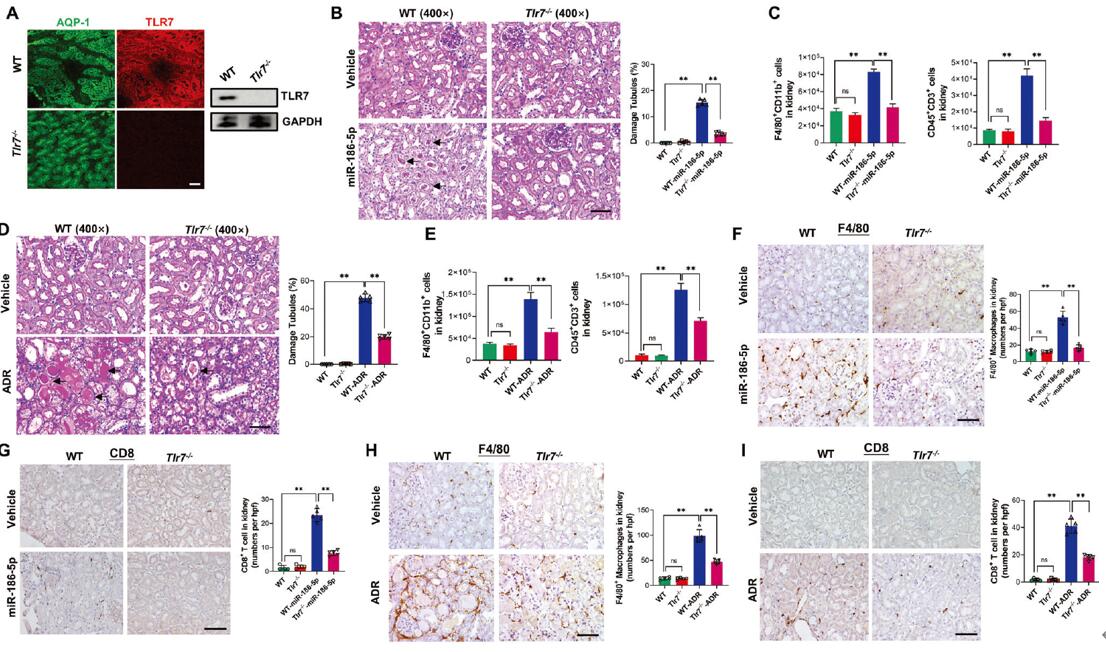
图7. TLR7缺陷小鼠可以抵抗miR-186-5p或ADR诱导的肾脏炎症和肾损伤
此外,作者还构建了TLR7干扰AAV病毒(AAV-TLR7 shRNA),在ADR处理前2周将AAV-TLR7 shRNA直接注射到肾皮质中(注射6个不同的点,10μl/点),显著敲低了肾小管中TLR7的表达,同时抑制了由miR-186-5p诱导的F4/80+巨噬细胞、CD8 T细胞或CD45+CD3+ T细胞的肾脏浸润(补充图10)。这些结果表明,TLR7缺陷小鼠可以抵抗miR-186-5p或ADR处理引起的肾脏炎症和肾损伤。
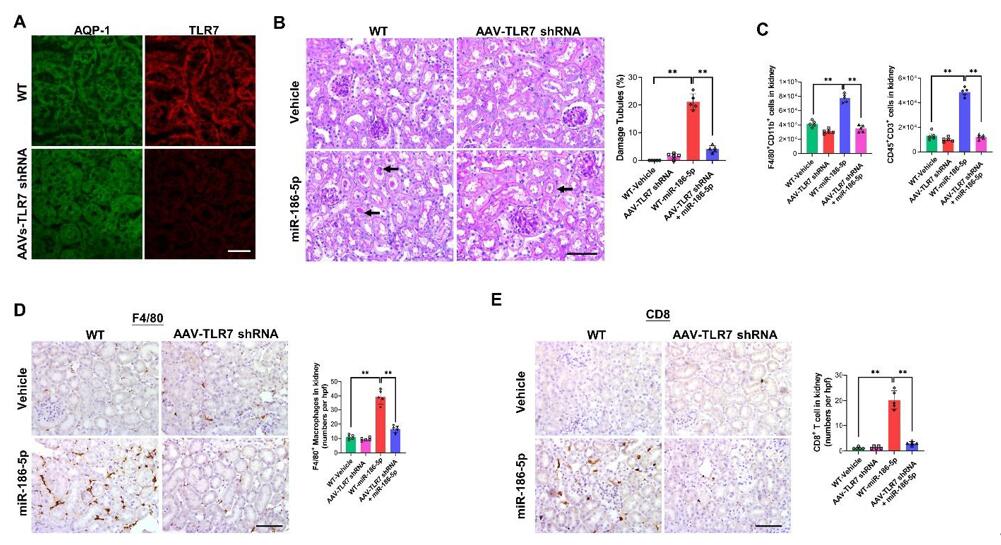
补充图10. 通过肾内注射AAV-TLR7 shRNA以敲低肾小管中TLR7的表达,可减轻miR-186-5p诱导的肾小管损伤和免疫细胞浸润
综上所述,作者通过分析FSGS患者、野生型小鼠和Tlr7缺陷小鼠分别接受ADR或miR-186-5p处理后肾组织的情况,证明了由活化CD8 T细胞分泌包含miR-186-5p的外泌体可以引起肾脏炎症和肾组织损伤,通过敲低miR-186-5p或阻断TLR7/8信号传导可显著减轻肾功能障碍。这些结果首次阐明了外泌体miR-186-5p作为T细胞介导肾功能障碍的循环致病因子及其作用机制,因此靶向抑制miR-186-5p-TLR7/8信号轴可成为减轻T细胞介导肾功能障碍的潜在有效方法。
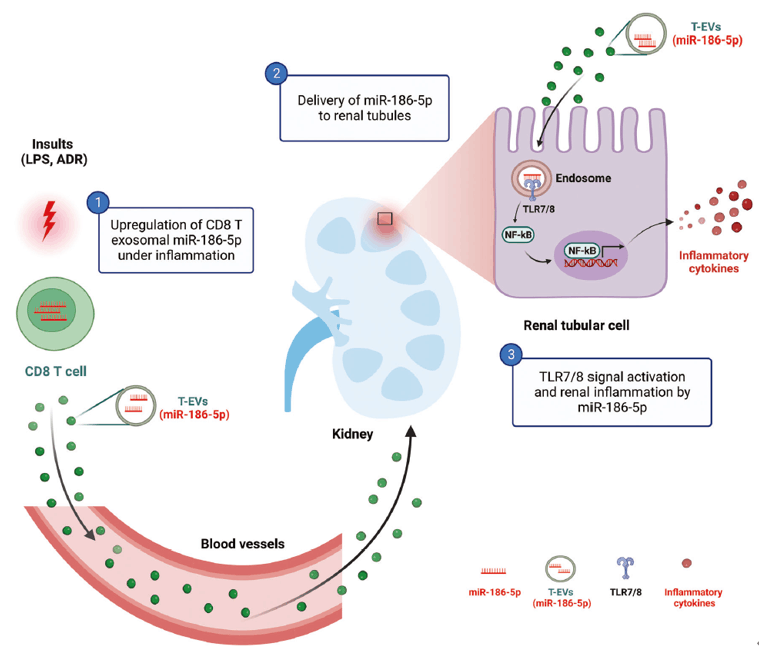
图8. CD8 T细胞外泌体miR-186-5p作为循环致病因子,通过激活肾小管TLR7/8信号引起肾脏炎症和组织损伤的示意图
参考文献:
[1] Zhang C, Zhang W, Chen HM, Liu C, Wu J, Shi S, Liu ZH. Plasma microRNA-186 and proteinuria in focal segmental glomerulosclerosis. Am J Kidney Dis. 2015 Feb;65(2):223-32. doi: 10.1053/j.ajkd.2014.07.013.
[2] Wang Y, Liang H, Jin F, Yan X, Xu G, Hu H, Liang G, Zhan S, Hu X, Zhao Q, Liu Y, Jiang ZY, Zhang CY, Chen X, Zen K. Injured liver-released miRNA-122 elicits acute pulmonary inflammation via activating alveolar macrophage TLR7 signaling pathway. Proc Natl Acad Sci U S A. 2019 Mar 26;116(13): 6162-6171. doi: 10.1073/pnas.1814139116.
[3] Masum MA, Ichii O, Elewa YHA, Kon Y. Podocyte Injury Through Interaction Between Tlr8 and Its Endogenous Ligand miR-21 in Obstructed and Its Collateral Kidney. Front Immunol. 2021 Jan 22;11:606488. doi: 10.3389/fimmu.2020.606488.

查看更多

查看更多

查看更多

联系我们

返回顶部