查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息
在蛋白质相关研究中,传统分离技术如:电泳、色谱和沉淀法等提供了蛋白质的初步分离手段,其中电泳主要根据蛋白质的大小进行分离,但难以区分分子量相近的蛋白质;亲和色谱则依赖特定配体,且需要特定条件。传统分离技术在分辨率和特异性上存在局限,这些技术限制推动了科学家寻找更精确的识别和分离方法,因此,免疫沉淀(Immunoprecipitation,IP)技术应运而生,并成为了现代生物医学研究中不可或缺的蛋白研究工具。

IP是一种利用特异性抗体结合抗原,并通过沉淀富集的方式从复杂的样本中分离出目标蛋白的方法。最初,IP技术是作为亲和柱色谱的一种改进方法而开发的,在微量离心管中使用少量的琼脂糖树脂完成。随着技术的进步,磁性微粒(磁珠)逐渐取代了琼脂糖,成为IP的首选支持物,提高了IP的纯度和可重复性。另外,自20世纪70年代单克隆抗体技术发展以来,全面提升了抗原-抗体结合的特异性和灵敏度,使得IP在蛋白互作等领域发挥着越来越重要的作用。更重要的是,根据检测目的的不同,IP的发展催生了免疫共沉淀(Co-Immunoprecipitation,Co-IP)、染色质免疫共沉淀(Chromatin Immunoprecipitation,ChIP)和RNA免疫共沉淀(RNA Binding Protein Immunoprecipitation,RIP)等衍生技术,能够有效反映活细胞内蛋白与蛋白、蛋白与其他生物分子间的生理性相互作用。
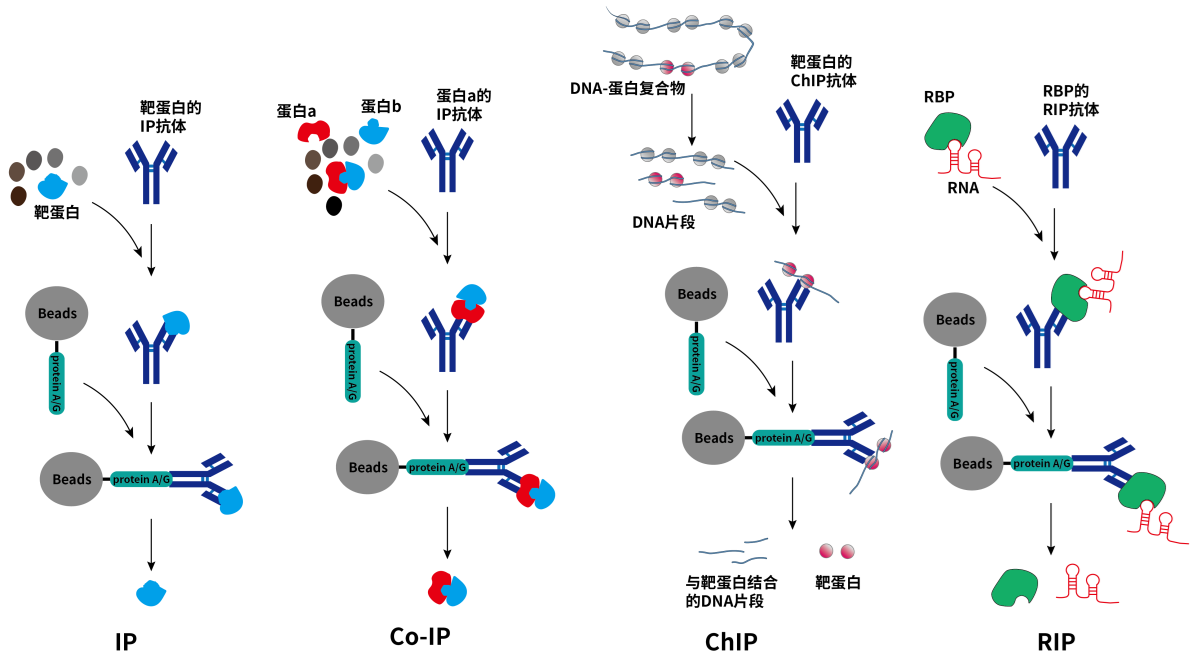
图1. IP及其衍生技术示意图
Co-IP:用于检测两种或两种以上蛋白质之间的相互作用。通过使用针对不同蛋白质的抗体,Co-IP可以揭示蛋白质复合体的组成成分,是研究信号传导和细胞调控网络的有力工具。
ChIP:专注于研究蛋白质与DNA的相互作用,尤其是转录因子或组蛋白修饰与特定基因启动子区域的结合。ChIP实验结合了IP和DNA测序(ChIP-Seq)技术,极大地推进了表观遗传学和转录调控领域的研究进展。
RIP:用于研究RNA分子与蛋白质的相互作用,如RNA结合蛋白(RBPs)与目标RNA的结合。RIP技术有助于理解RNA加工、运输、稳定性以及RNA介导的基因调控机制。
下面,我们首先从IP实验技术开始为大家进行详细的介绍,Co-IP、ChIP以及RIP的知识分享将在后续的推文中分期为大家一一介绍。
免疫沉淀(IP)实验
IP用于从复杂的生物样本中分离和纯化特定蛋白质,依赖于抗体对目标蛋白的特异性识别并形成抗原-抗体复合物,然后通过物理方法(如离心或磁珠)将这些复合物沉淀下来,再结合Western blot(WB)或质谱(mass spectrum,MS)对目标蛋白进行检测分析,即可对目标蛋白进行定性/定量分析。接下来,我们从IP实验目的、IP实验原理、IP实验步骤、IP实验结果解读和IP优缺点及常见问题分析等方面对于IP实验技术进行具体解析。
1、IP主要实验目的
(1)鉴定特定蛋白的存在和表达水平;
(2)研究蛋白的翻译后修饰,如磷酸化、甲基化等;
(3)确定蛋白复合物的形成;
(4)纯化目的蛋白以进行进一步的分析。
2、IP实验原理
将含有目的蛋白的样品溶液与特异性抗体结合,该抗体的Fc片段又能结合到protein A/G上,protein A/G(结合了protein A和protein B的IgG结合结构域,具有与IgG的Fc片段特异性结合的能力,可用于抗体的亲和纯化。)通常会固定在琼脂糖颗粒或磁珠上,进而吸附目的蛋白,后续再通过离心收集、洗脱、溶解等步骤分离获得目的蛋白。抗体可以预先固定在固相支持物(琼脂糖或磁珠上);也可以先是游离状态时与目的蛋白结合后再结合到固相支持物上,回收抗原-抗体复合物。
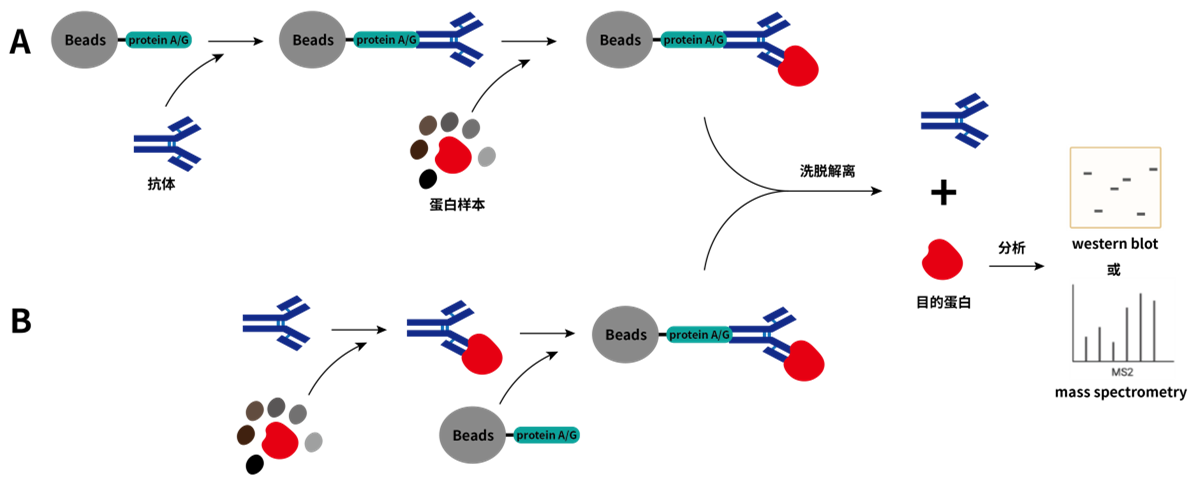
图2. 预固定抗体(A)和游离抗体(B)进行免疫沉淀的示意图
3、IP实验步骤
(1)收集细胞于离心管中,4 ℃以500 g离心5 min,弃上清;使用预冷的1×PBS洗涤细胞1-2次,同时离心去除上清;
(2)加入500 μL含蛋白酶抑制剂的IP裂解/洗涤缓冲液于冰上裂解细胞30 min;
(3)将裂解液于4 ℃以10000 g离心30 min,取上清;
(4)预留少量上清液(约10-20 μL)用于WB实验,作为Input样本;
(5)将2-10 μg的抗体(具体参考抗体说明书)与剩余的上清液混合,在4 ℃摇床孵育1 h或过夜,以形成抗原-抗体复合物;
(6)根据试剂说明书制备protein A/G-beads,将抗原-抗体复合物与50 μL的protein A/G-beads混合,4 ℃摇床孵育1-4 h,4 ℃以3000 g离心5 min收集沉淀,小心弃去上清;
(7)用500 μL裂解缓冲液洗涤protein A/G-beads 3-4次,每次洗涤后需离心;
(8)根据相应的洗脱方法,使用50 μL洗脱缓冲液洗脱抗原-抗体复合物,得到目的蛋白;
(9)对目的蛋白进行WB检测或MS分析。
4、IP实验结果解读
(1)IP-WB:
图3展示了IP后的WB检测结果示意图,解读结果前先认识一下各标注的含义:
Input:指阳性对照,使用预留的细胞裂解液进行WB,以确认目的蛋白的存在,排除假阳性结果的干扰。
IP:指用对应的抗体来富集目的蛋白,例如IP中的a是指用了蛋白a的IP抗体去富集样本中的蛋白a。
WB:用来检测样本中目的蛋白的存在与否,例如WB中的a是指用蛋白a的抗体去检测样本中的蛋白a是否存在。
IgG:用于做IP的阴性对照。
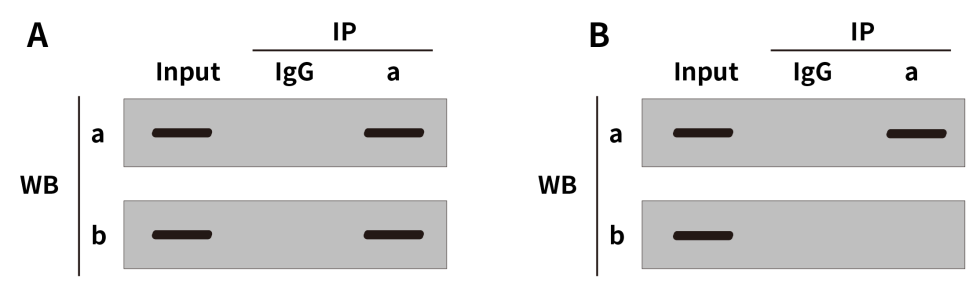
图3. IP实验结果参考示意图
根据标注含义分析,结果A和结果B是代表两种不同的结果。这两个结果的Input组都检测到了蛋白a和蛋白b,说明样本中含有这两种蛋白。结果A中,通过蛋白a的抗体进行IP可以靶向蛋白a的同时也沉淀下了蛋白b,表明蛋白a和蛋白b间存在相互作用。反之,结果B的IP样本中没有检测到蛋白b,即说明二者不存在互作。(需要注意的是,IP所检测到的相互作用不能反映是直接作用还是间接作用,研究具体作用机制需要进一步分析检测。)
(2)IP-MS:
IP-MS可以进一步定量分析蛋白的丰度和鉴定蛋白间的相互作用。
① 在定量分析中,关键指标包括Fold Change和Intensity,Fold Change表示实验组与对照组间蛋白丰度的差异倍数,Intensity则反映蛋白质的相对丰度。根据实际情况设定合理的Fold Change阈值和P值,进而评估蛋白表达差异和统计学显著性。
② 在蛋白互作分析中,重点关注Intensity数值较大且Fold Change较高的蛋白,提示它们可能与目标蛋白有显著的相互作用。同时,需要警惕可能的非特异性结合,特别是当某蛋白的Fold Change和Intensity高于靶蛋白时。
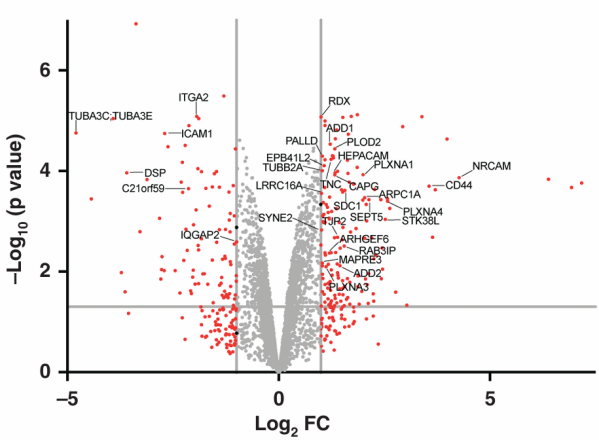
图4. IP-MS火山图示例[1]
5、IP优缺点及常见问题解析
IP的优点在于其特异性高、应用范围广、能反映蛋白间的生理性相互作用,以及可与WB和质谱等技术联用,进行深入的蛋白质分析。然而,IP也存在一些局限性,包括可能出现的非特异性结合、依赖于高质量抗体、以及实验操作熟练度等。因此在实际的实验操作过程中,大家可能会遇到一些常见的实验问题,小恒整理了相关问题及对应的解决方案供大家参考:
实验问题1:WB显色结果有大范围的深色背景:
可能原因:封闭不充分;一抗的浓度过高或是孵育时间过长;洗膜不充分;抗体特异性不佳;显色时间较长。
解决方案:孵一抗前可4℃封闭过夜;将一抗稀释至适合的浓度,还可适当缩短抗体孵育时间;抗体孵育后充分洗膜;更换特异性更好的抗体。
实验问题2:免疫沉淀下来的蛋白量较少:
可能原因:目的蛋白丰度低;抗体亲和力不足。
解决方案:若是蛋白本底表达量低,可以考虑将目的基因构建到质粒或病毒载体上进行外源性过表达,若目的蛋白没有合适的抗体,还可以通过融合表达标签蛋白(如3*flag、HA等),借助标签蛋白的抗体进行免疫沉淀;另一方面,可以调整IP的加样顺序,即蛋白丰度低时采用抗原和抗体先结合,再加入磁珠孵育,能更好地富集目的蛋白。抗体方面,需重新更换、测试、评估新抗体的亲和性和特异性。
实验问题3:出现假阳性或假阴性结果:
可能原因:抗体与非特异性蛋白交叉反应导致的假阳性;目的蛋白未被沉淀或裂解过程中被降解,导致假阴性。
解决方案:设置合理的对照。例如对于假阳性,可使用非特异性的IgG抗体作对照;对于假阴性,可充分裂解细胞,操作过程中使用蛋白酶抑制剂以防止蛋白降解等。
实验问题4:IP样本洗脱后未检测到目的蛋白:
可能原因:洗脱条件不适宜;目的蛋白在该细胞中本底表达量低?
解决方案:可使用多种洗脱缓冲液进行比较,找到最合适的洗脱条件。一般可分为变性洗脱和非变性洗脱。变性洗脱是用SDS-PAGE上样缓冲液使蛋白变性,可有效解离抗原-抗体的亲和作用,方便后续做WB检测。如果后续需要进行功能性分析,则需要使用非变性的酸性洗脱法(0.1M甘氨酸,pH2.5-3),可解离大多数抗原-抗体互作的同时保留目的蛋白的活性。
实验问题5:Input中无条带但IP中有;或者相反Input中有条带,而IP中没有:
可能原因:Input中无条带但IP中有可能是目的蛋白丰度低,WB的一抗不够灵敏,而经IP富集后可检测到;另一种情况则可能是IP所用的抗体是识别蛋白内部的线性表位,而不是构象表位,导致无法捕获目的蛋白。
解决方案:第一种情况可以选择灵敏度更高的抗体,或通过外源性过表达来提高目的蛋白的丰度;对于第二种情况,在兼顾抗体特异性的同时,选择适用于IP的抗体是关键。
综上,本文介绍了IP技术及其在生物医学研究中的应用,包括实验目的、实验原理、实验步骤、实验结果解读和常见问题分析及解决方案。IP技术有助于分离和分析特定蛋白质,为深入理解蛋白质功能提供了重要工具。那么如果需要研究更为复杂的蛋白互作网络,Co-IP则是更适合的方法,下期我们将继续介绍Co-IP实验的相关内容,欢迎大家持续关注~
参考文献
[1] Demirdizen E, Al-Ali R, Narayanan A, et al. TRIM67 drives tumorigenesis in oligodendrogliomas through Rho GTPase-dependent membrane blebbing. Neuro Oncol. 2023;25(6):1031-1043. doi:10.1093/neuonc/noac233.

查看更多

查看更多

查看更多

联系我们

返回顶部