查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息

严重急性呼吸综合征冠状病毒2型(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)自 2020 年初爆发以来,在全球迅速传播,引发了大流行,导致大量感染和死亡。世界各地的科学家正在努力更好地了解 SARS-CoV-2 的传播机制、病理特征、诊断工具和治疗方法。一些有效的治疗和预防措施,包括抗病毒药物和血浆疗法,已经诞生。然而,仍然需要更多的研究来探索 SARS-CoV-2 的生物学特性以防治其危害。研究发现SARS-CoV-2 非结构蛋白 nsp12、nsp7和nsp8可形成多亚基复制/转录复合物。其中,nsp7 和 nsp8 协助增强nsp12的模板结合和 RNA 合成能力。nsp12又称 SARS-CoV-2 RdRp,是核心催化亚基,对病毒复制和传播至关重要。nsp12也是SARS-CoV-2 中最保守的蛋白质之一,且有研究表明nsp12可抑制宿主 I 型干扰素 (IFN-I) 反应,因此,nsp12 也是SARS-CoV-2的一个有希望的治疗靶点。

2023年8月16日,西安交通大学第一附属医院杨琪团队在《Chemical Engineering Journal》上在线发表了题为“Lung-targeted delivery of nsp12 siRNAs restores host type I interferon responses”的研究论文,设计了特异性靶向SARS-CoV-2 nsp12 的 siRNA,并通过一系列体外和体内实验建立了一种肺靶向系统,利用RBD-11b 修饰的阳离子脂质体将nsp12 siRNAs(nsp12 siRNAs@RBD-11b-CLs)递送至小鼠肺中。结果发现其可高效抑制小鼠肺中外源性nsp12的表达,并显著恢复宿主的 I 型干扰素反应。这项研究将为SARS-CoV-2和其他 RNA 病毒的治疗提供新的视角和方法。值得注意的是,在本研究中,作者使用了汉恒生物提供的纯化腺病毒产品在小鼠肺部进行nsp12基因过表达。
接下来,让我们一起来了解一下这篇文章吧。
nsp12对SARS-CoV-2 基因组复制、转录和病毒包装过程至关重要,此外,nsp12 还能调节 IRF3- IFN-I 介导的宿主细胞抗病毒反应。因此,用 siRNA 靶向宿主细胞中的 nsp12 将阻断 SARS-CoV-2 的 RNA 合成和转录,恢复宿主细胞中 IFN-I 通路的正常激活。
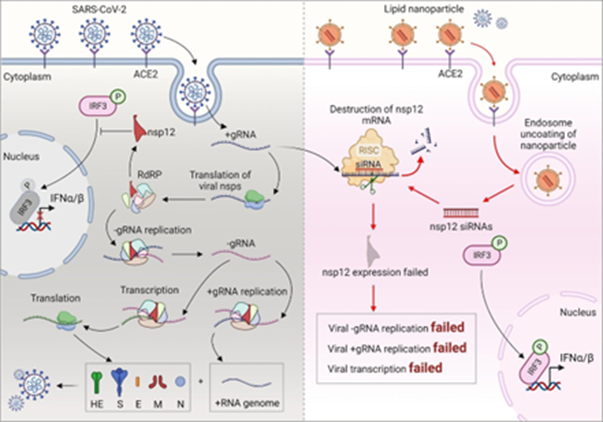
图1. nsp12 siRNAs@RBD-11b-CLs功能示意图
首先,作者进行了nsp12 siRNA的体外筛选实验。将nsp12基因的RdRp结构域(366至920氨基酸残基)与荧光素酶基因融合构建到质粒上。随后,构建了过表达nsp12 (RdRp)-luciferase的HEK293T细胞,用于筛选特异性靶向nsp12的siRNA。为了敲低宿主细胞中的 nsp12,作者合成了三组 nsp12 siRNA,即 nsp12 siRNA-1、-2 和 -3,以及一组非靶向的阴性对照siNC。将这些 siRNA 转染到表达nsp12 (RdRp)-luciferase的 HEK293T 细胞中。结果显示,nsp12 siRNA-1、-2 和 -3 显著降低了 HEK293T 细胞中 nsp12 的 mRNA 水平和蛋白水平,并抑制了荧光素酶的活性。这些结果表明这些nsp12 siRNA可抑制nsp12 的表达。
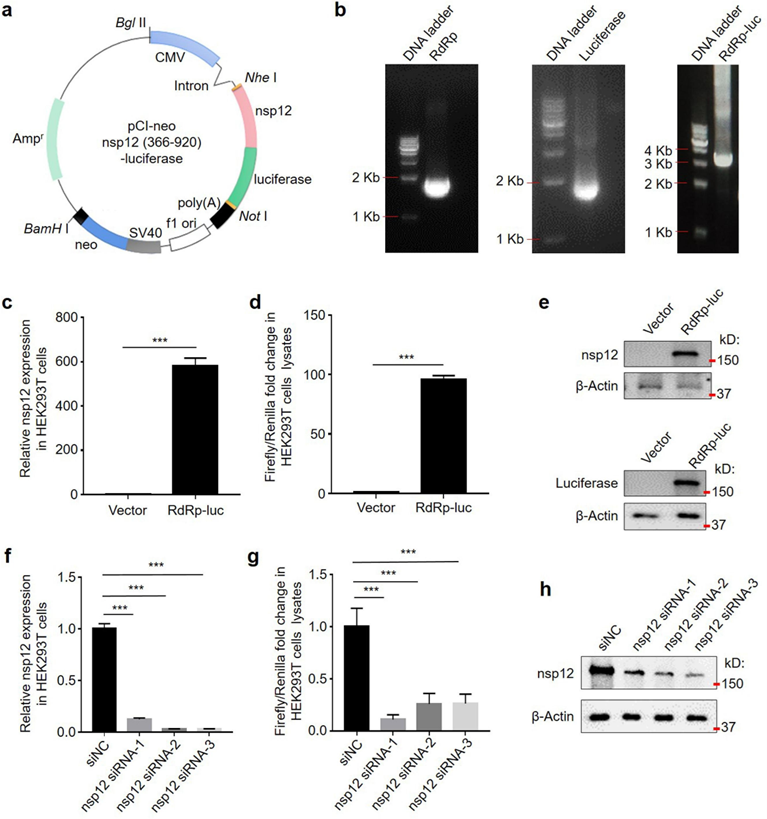
图2. nsp12 siRNA的筛选
人血管紧张素转换酶 2 (ACE2) 是病毒进入时 SARS-CoV 和 SARS-CoV2 的功能性受体,广泛表达于多种人体细胞表面,尤其是肺和肾细胞。来自SARS-CoV受体结合域 (RBD) 的肽 RBD-11b (YKYRYL) 已被证明对 SARS-CoV 与宿主细胞 ACE2 受体的结合起着关键重要。因此,利用这种肽可能是实现肺靶向药物输送的有效策略。
作者分析了ACE2与RBD-11b的结合位点,发现该位点在人和小鼠中具有同源性。为了验证是否可以利用RBD-11b实现非靶向药物递送,作者构建了高表达小鼠ACE2-mCherry融合蛋白的HEK293T细胞株,合成RBD-11b标记的脂质体,并负载上荧光染料Dio,将其命名为RBD-11b-lipo-Dio。与RBD-11b-Lio-Dio(15μL脂质体,含约100μM RBD-11b和50μg/mL Dio)孵育1.5小时后,表达小鼠ACE2的细胞吞噬脂质体,从而显示出绿色荧光信号,而对照组几乎没有绿色荧光信号。这一发现表明小鼠 ACE2 对 RBD-11b 多肽的敏感性与人类 ACE2 完全相同。为了验证RBD-11b与小鼠ACE2相互作用的序列特异性,作者分别合成了在RBD-11b的第二、第三和第四个氨基酸处突变的肽(YAYRYL、YKARYL 和 YKYAYL)。分别用等量的对照脂质体(lipo-Dio )、RBD-11b-lipo-Dio 和用三种突变肽修饰的脂质体处理表达小鼠 ACE2 的 HEK293T 细胞1.5小时。结果发现,对照脂质体未被细胞吸收,而RBD-11b-lipo-Dio则被细胞大量吸收。这表明RBD-11b 促进了表达小鼠 ACE2 的细胞更早、更强地吸收脂质体,证实了 RBD-11b 与小鼠 ACE2 的靶向结合。而三种突变多肽组则阻碍了RBD-11b 介导脂质体的内吞作用,表明了 RBD-11b与小鼠 ACE2的结合具有特异性。
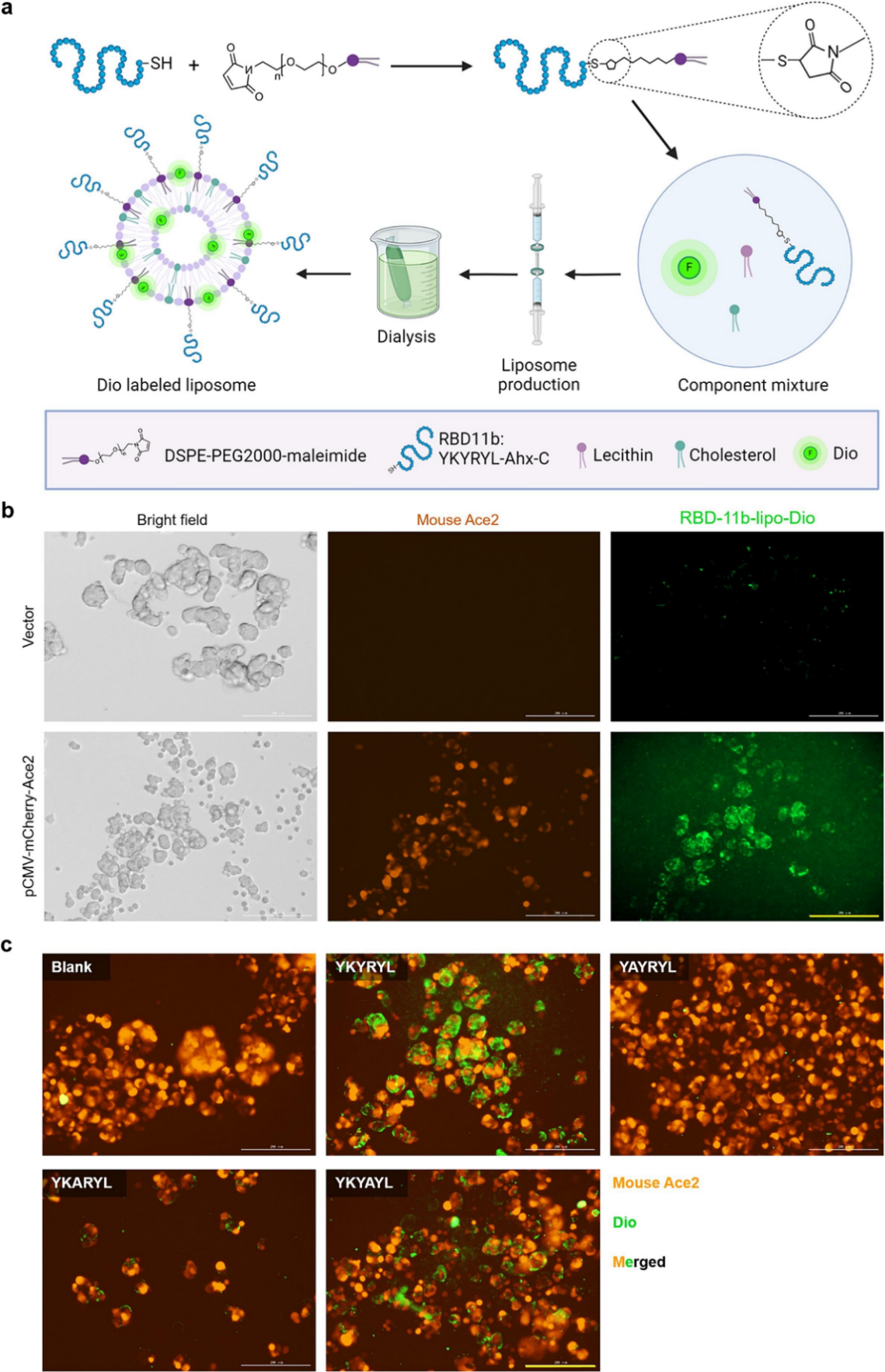
图3. RBD-11b 特异性靶向小鼠 ACE2
DOTAP (1,2-二油酰-3-三甲基铵-丙烷)是一种阳离子脂质试剂(CL),常用作细胞膜透过性增强剂、基因递送载体或药物递送系统的一种组分,其已被证明适合用于肺部药物输送,将其与中性脂质体结合可能是递送 siRNA 的最佳选择。因此,作者准备使用 RBD-11b 标记的 CL 来实现更好的肺靶向递送 nsp12 siRNA。用 Cy5 荧光标记 nsp12 siRNA 的 5′ 端,然后将其装载到 CL 中。电子显微镜下,肺靶向脂质体(siRNA-Cy5@RBD-11b-CLs)和非靶向对照脂质体(siRNA-Cy5@CLs)均为球形,大小均匀,表面光滑。动态光散射测量显示siRNA-Cy5@CLs和siRNA-Cy5@RBD-11b-CLs的粒径分别为110±27nm和114±33nm,多分散性指数(PDI)<0.2,表明脂质体对于静脉或腹腔使用是安全的。将100ul siRNA-脂质体复合物经尾静脉注射小鼠体内后,原位和体外成像均表明RBD-11b-CLs能有效地将siRNA-Cy5递送至小鼠肺部,而siRNA-Cy5@CLs则几乎完全在肝脏中富集。进一步研究表明,siRNA-Cy5@RBD-11b-CLs处理的小鼠肺中Cy5荧光强度明显高于siRNA-Cy5@CLs处理小鼠。这些结果表明RBD-11b-CLs能高效地将siRNA递送至小鼠肺部。
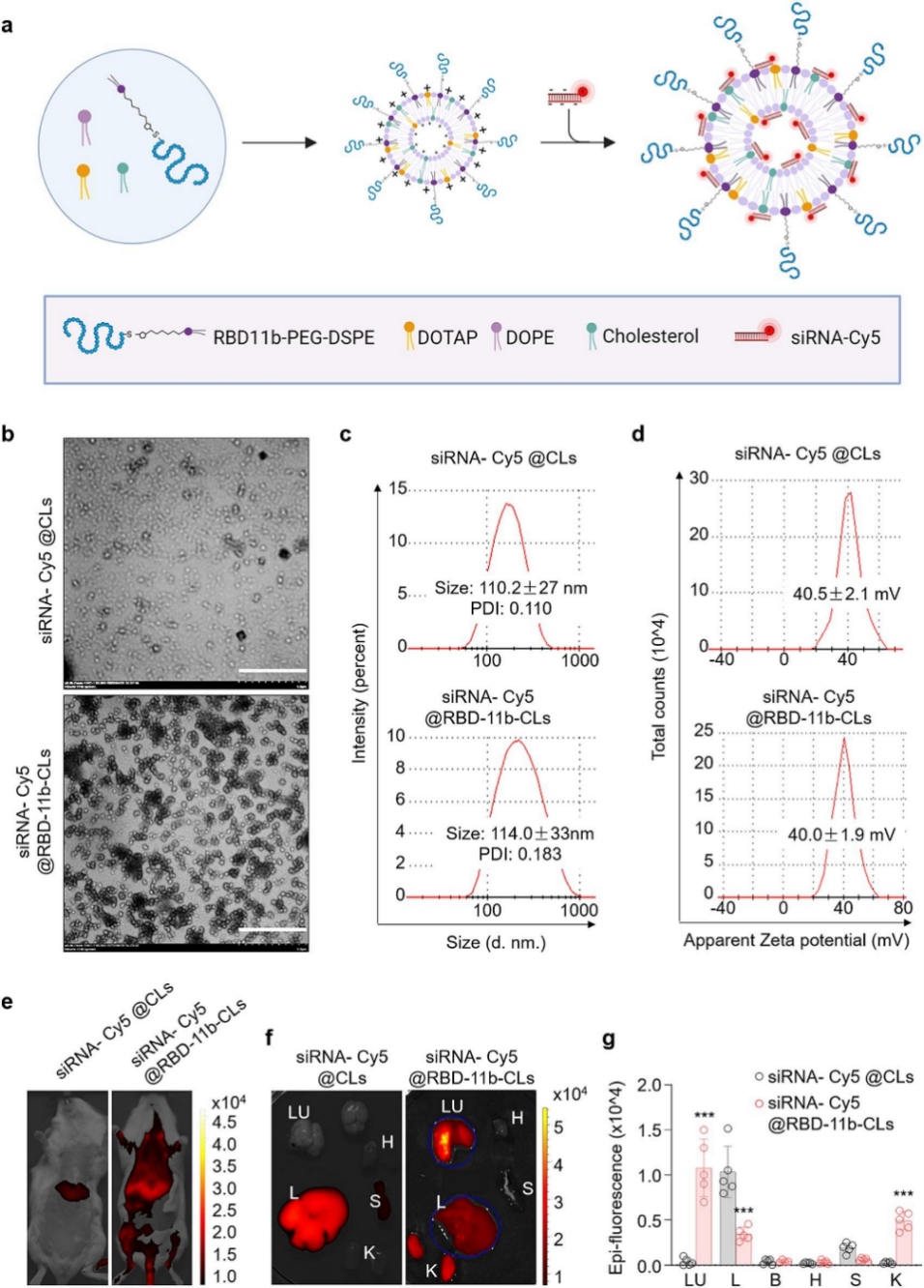
图4. nsp12 siRNAs@RBD-11b-CLs的表征及肺靶向性
为了模拟小鼠肺细胞中nsp12的表达,作者将过表达nsp12-luciferase的腺病毒(Adv-nsp12),通过气管插管方式递送到小鼠肺部,然后通过发光成像监测不同时间点的荧光素酶表达情况。结果显示,在病毒注射后第2天至第6天,小鼠肺中均可检测到腺病毒介导的荧光素酶活性。与第二天相比,第6天和第8天肺中的发光强度明显降低。在病毒注射后第4天和第8天处死小鼠,然后对胸腹部器官进行发光检测。结果显示,在病毒注射后第4天,小鼠肺显示出强的发光信号,但在第8天信号消失。基于以上发现,作者从Adv-nsp12给药第2 天起,每天对小鼠进行三次nsp12 siRNAs@RBD-11b-CLs静脉注射(每只小鼠每天注射每种nsp12 siRNA 2.5 nmol),以PBS或 siNC@RBD-11b-CLs(每只小鼠每天 7.5 nmol siRNA)注射作为对照。在第4天结束时,通过发光成像评估nsp12-luciferase的表达情况。结果发现PBS 和 siNC@RBD-11b-CLs 未能改变肺中荧光素酶的表达,nsp12 siRNAs@RBD-11b-CLs 显著抑制了荧光素酶的表达。与对照小鼠相比,nsp12 siRNAs@RBD-11b-CLs 处理的小鼠的肺组织中 nsp12 的表达受到显著抑制。对不同器官进行免疫组化染色,均未发现nsp12 siRNAs@RBD-11b-CLs中各器官有明显损伤,表明siRNAs@RBD-11b-CLs在具有靶向抑制小鼠肺部nsp12表达的同时,还具有良好的生物安全性。
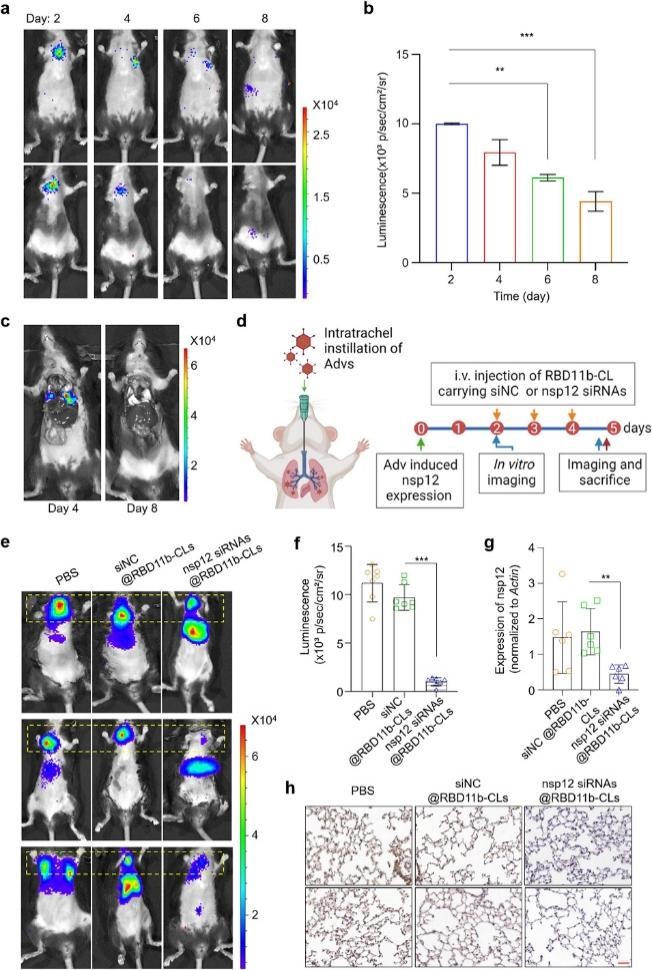
图5. siRNAs@RBD-11b-CLs在体内可抑制外源性nsp12表达
有研究表明,SARS-CoV-2 的 nsp12 通过阻止 IRF3 核易位显著阻断 IFN-I 反应。为此,作者试图确定 nsp12 siRNA 对 Adv-nsp12 感染肺细胞中 IFN-I 活性的影响。通过 IHC 分析IRF3 的亚细胞定位,发现在用 PBS 和 siNC@RBD-11b-CLs 处理的小鼠肺泡细胞中 IRF3 主要在细胞质中表达而不是在细胞核中表达,而在 nsp12 siRNAs@RBD-11b-CLs 处理的细胞中更多的 IRF3 进入细胞核。由于IRF3 是 IFNβ 的有效转录因子,作者又通过 RT-qPCR 和 ELISA 测定检测了 nsp12 siRNAs@RBD-11b-CLs 处理的小鼠和 PBS 或 siNC@RBD-11b-CLs 处理的小鼠肺组织中 IFNβ 的表达情况。结果与对照小鼠相比,无论是mRNA水平还是蛋白水平,nsp12 siRNAs@RBD-11b-CLs 显著提高了小鼠肺中 IFNβ 的表达。 接下来,作者又研究了 nsp12 敲低对干扰素刺激基因 (ISG) 表达的影响。PKR 是一种典型的 ISG,在病毒感染的上皮细胞中表达,通过抑制蛋白质合成来阻止病毒颗粒的形成。RT-qPCR 和免疫荧光试验均表明,与对照组相比,nsp12 敲低显著促进了 Adv-nsp12 感染肺中 PKR 的表达。这些数据表明了nsp12 siRNAs@RBD-11b-CLs 介导的小鼠肺中 nsp12 敲低可以通过恢复 IFN-I 反应有效激活宿主的抗病毒免疫。
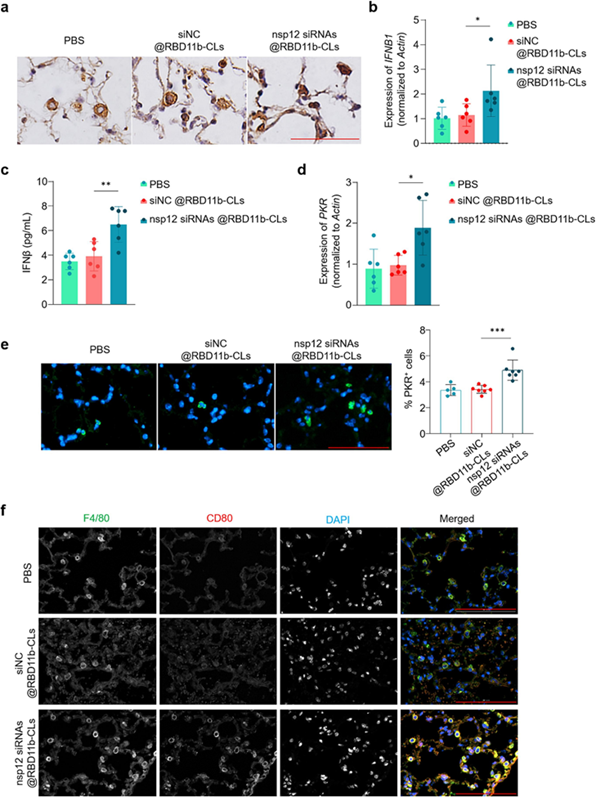
图6. Nsp12 siRNAs@RBD-11b-CLs 重新激活宿主的 IFN-I 反应
综上所述,本研究筛选并鉴定了有效抑制nsp12的siRNA。并且RBD-11b 标记的 CL 可以高效特异性地将 nsp12 siRNA 递送到小鼠肺部,从而抑制 nsp12 的外源表达。此外,通过这种策略抑制 nsp12 可以显著恢复宿主的 IFN-I 反应。这项研究将为 RNA 病毒(包括 SARS-CoV-2)的预防和管理提供新的视角和新的研究方向。

查看更多

查看更多

查看更多

联系我们

返回顶部