查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息
上一期干货内容我们为大家介绍了子宫及胚胎特异性基因调控策略,本期将继续带大家了解肺脏特异性基因调控策略,主要从肺组织特性及组成、肺部的常见疾病、肺嗜性AAV血清型、肺特异性启动子和病毒递送到肺部的方法等五个方面展开分享。

一、肺组织特性及组成
肺脏(Lung),在呼吸空气的哺乳动物、脊椎动物、爬行动物等动物中,是位于胸腔中的两个大的呼吸器官之一,其主要功能是将氧气输送入血液,并将二氧化碳排出体外。肺脏主要包含将空气输送到气体交换区和从气体交换区输送空气的纯传导气道(支气管和细支气管)、许多代表腺泡的气体交换气道(呼吸细支气管和肺泡管)、为最远端的纯传导气道(末端细支气管)提供服务的单位(肺腺泡)以及支气管树的终末部分(肺泡),肺泡是肺部气体交换的主要部分,也是肺的功能单位。在人类中,每个肺都被包裹在一个称为胸膜的薄膜囊中,除呼吸调节功能外、肺脏还承载着免疫、肺循环、造血等多种重要的功能。
图1. 肺脏的组成及气体交换示意图(https://www.britannica.com/science/lung)
肺,由终末气道、肺泡和肺间质组成,可进一步分为两个主要区域:传导气道区和呼吸区。其中气道上皮是一个连续的细胞层,主要由上皮细胞(纤毛细胞)、基底细胞、杯状细胞、球杆细胞和肺神经内分泌细胞组成。肺泡是呼吸系统中最小的通道,肺中含有超过3亿个肺泡,由I型和II型肺细胞组成。I型肺细胞的功能是允许气体交换,而II型肺细胞负责分泌表面活性剂,降低肺泡的表面张力。肺泡巨噬细胞和树突状细胞负责通过吞噬作用清除碎片[1-2]。
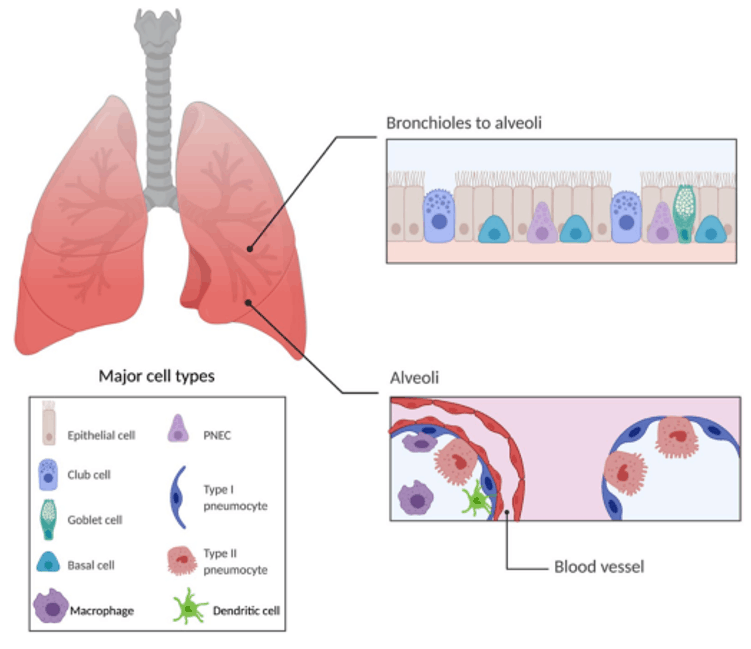
图2. 肺部主要细胞类型示意图[3](PMID: 35241085)
二、肺部的常见疾病
近年来,多种传染性呼吸道系统疾病导致医疗系统的超负荷运营,对普通人健康的生活和正常的肺部功能影响也甚为广泛,并可导致携带基础疾病人群的严重并发症甚至死亡。2019年,据世界卫生组织统计十大全球死亡病因分析结果显示,呼吸系统疾病占据3位,其中慢性阻塞性肺炎(死亡人数:322万人)排在第3位,下呼吸道感染(死亡人数:259万人)排在第4位,肺癌(死亡人数:176万人)排在第6位(以上数据来源于WHO官网)。哮喘也被认为是最常见的慢性肺部疾病,占全球儿童总数的14%,在这一群体中,肺炎也是5岁以下儿童死亡的主要原因。除此之外,还有气道过敏性疾病、囊性纤维化、肺结核等呼吸系统疾病[4]。因此,研究肺部疾病靶向型药物及治疗方案需要取得更全面、更高效的突破性进展。
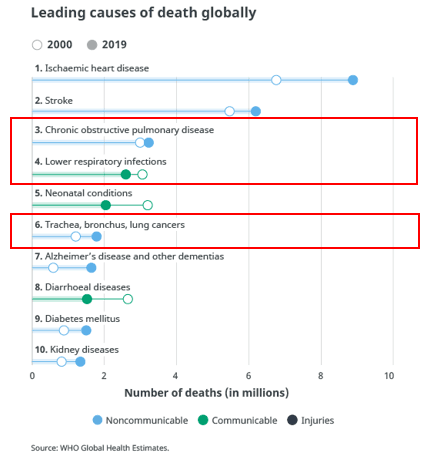
图3. 2019年全球十大死亡原因统计结果(数据来源于WHO官网)
肺部感染的研究相对成熟,主要通过直接靶向肺组织注射携带目标靶基因的AAV载体即可达到治疗目的。重组腺相关病毒(rAAV)作为最常用的基因治疗载体之一,具有宿主范围广、安全性高、免疫原性低、表达稳定等优点,已被广泛地应用于基础研究和临床试验的基因治疗应用中。本文将结合相关研究案例详细介绍肺组织靶向性AAV的选择,包括血清型、特异性启动子以及肺组织感染的注射方式等,希望能够为相关研究的科研工作者们提供一些思路和帮助。
三、肺嗜性AAV血清型
近年来,AAV血清型靶向性研究比较广泛,多种AAV血清型均可针对肺部进行感染,比如AAV2、AAV5、AAV6及AAV9等。2020年,牛津大学Helena Meyer-Berg等[5]研究者通过建立肺芽样器官(lung bud organoids,LBOs)模型——由人胚胎干细胞(hESCs)生成的一种人肺实质模型,用于筛选、确定适用于人肺实质转导的血清型。研究证实在所选用的八种AAV血清型中,rAAV2和rAAV6以及rAAV6变体(rAAV6.2和rAAV6.2FF),对人肺实质亲和性较强。Excoffon等[6]发现了单一的AAV变体AAV2.5T,它是AAV2(aa1-128)和AAV5(aa129-725)之间的嵌合体,具有单点突变(A581T)。在转导后21天,AAV2.5T对于气道尖端细胞的感染效率优于其他评估的AAV血清型:AAV2 Luc(100倍)、AAV5 Luc(10倍)和AAV9 Luc(20倍)。在AAV2.5T和其他野生型血清型之间,没有观察到基底外侧转导的显著差异(图5B),表明AAV2.5T的优势对根尖表面是特异性的。Carmela等[7]研究显示了尾静脉注射1×1011 AAV颗粒后100天,肺组织中1-9血清型AAV病毒的持久性表达量。综上所述,AAV5和AAV6普遍被认为是用于肺部感染的相对理想的AAV血清型。
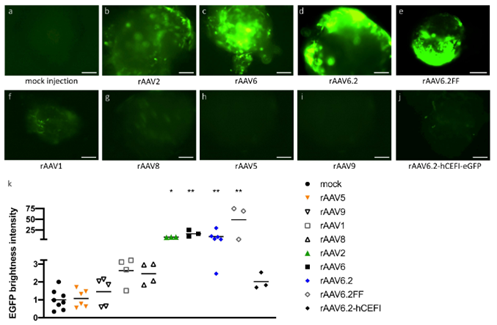
图4. AAV系统在肺组织中的表达[5](PMID: 33097094)
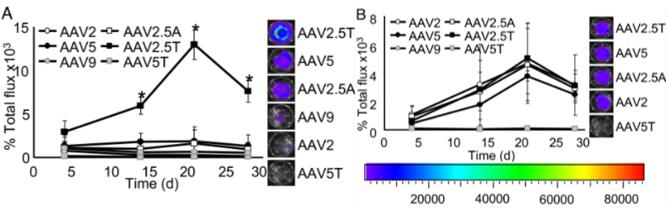
图5. AAV2.5T介导显著改善顶端气道转导,顶端(A)或基底外侧(B)[6](PMID: 19237554)
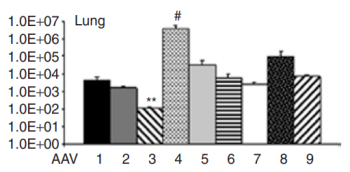
图6. AAV系统在肺组织中的表达[7](PMID: 18414476)
【汉恒文献速览】 首都医科大学王辰教授、中日友好医院肺与危重症医学科黄可和浙江大学医学院附属二院呼吸与危重症医学科陈志华研究员团队共同研究发现嗜酸性粒细胞来源的组织蛋白酶L在细胞外基质降解和建模中的重要作用,以及它与慢阻肺患者肺气肿的相关性。文章中使用的AAV2/5-m-Ctsl-EGFP病毒由汉恒生物提供[8]。
注射参数:
病毒类型:AAV2/5-si-m-Ctsl-EGFP
血清型:5型
病毒滴度:1.5×1012 vg/ml
目标部位:肺部
注射方法:气管内注射
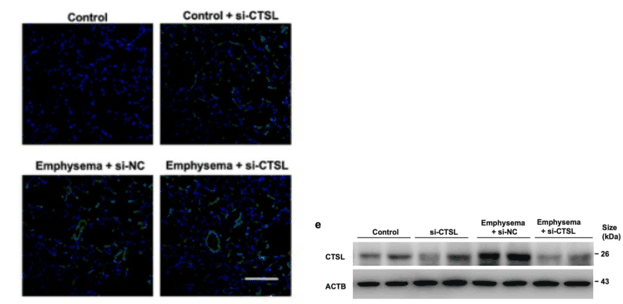
图7. 肺组织中EGFP的荧光图像(左),AAV-CTSL引起肺中CTSL的表达(右)[8](PMID: 37816708)
【汉恒文献速览】 福建医科大学林默君教授团队发现缺氧诱导的角蛋白1调控肺动脉平滑肌细胞PASMC的扩张,对肺动脉高压(PAH)具有预防作用。文章中使用的pHBAAV2/6-CMV-Krt1-3flag-T2A-ZsGreen病毒由汉恒生物提供[9]。
注射参数:
病毒类型:pHBAAV2/6-CMV-Krt1-3flag-T2A-ZsGreen
血清型:6型
病毒滴度:4.5 × 1012 vg/ml
目标部位:肺部
注射方法:气管内滴注
注射剂量:气管内滴注病毒预处理1周,再分别用21%和10%的O2维持营养不良或缺氧条件。
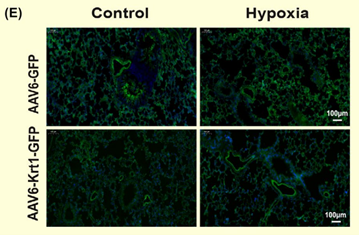
图8. Krt1在肺中表达的荧光[9](PMID: 32920982)
四、肺特异性启动子
基因治疗载体工具的选择,除了组织/器官靶向性的血清型外,不同类型肺部细胞也可以通过载体携带相应的特异性启动子来实现靶基因特异性启动表达的效果。汉恒生物不仅可以提供广谱启动子,如CMV、EF1A等,还推出了肺部广泛研究的靶细胞——肺泡2型上皮细胞(ATII)特异性启动子,可帮助您构建高效、特异性靶向肺组织的rAAV载体。
表1. 肺特异性启动子信息

SP-C特异性启动子
肺表面活性剂——在肺泡II型(ATII)细胞中产生,是磷脂和蛋白质的复杂混合物,其作用是降低肺泡的表面张力。表面活性剂的蛋白质组分由4种主要蛋白质组成,即表面活性剂蛋白SP-A、SP-B、SP-C和SP-D[10]。研究发现,把整个肺中的每种表达细胞类型分类为ATII、ATI、气道或非I型/非II型细胞,SP-C启动子优先增强ATII细胞中的基因递送和表达[11]。通过免疫荧光共定位染色证实了SP-C特异性启动目的基因在小鼠气管内插管注射AAV-6的小鼠中的过表达水平[12]。
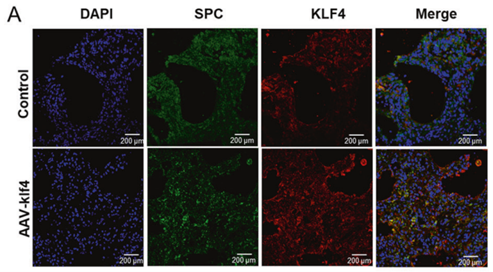
图9. KLF4在注射AAV-6的小鼠中的过表达[12](PMID: 35508454)
五、病毒递送方法
向肺组织中递送AAV病毒载体主要方式为局部注射,具体包括三种方式:滴鼻、气管插管注射和气管内注射[13],除此之外,也可通过腹膜内注射和静脉注射的方式进行感染(友情提示:肺部为呼吸系统最大的器官,与气管直接连接。因此,局部注射的三种感染方式的感染效率理论优于系统注射方式的感染效率)。具体注射方式和用量,建议老师们先进行预实验哦,选择最适合自己实验的AAV血清型、特异性启动子以及操作方式。关于肺部的AAV病毒递送方式详情可以参考下表:
表2. 肺脏感染的具体方式分类
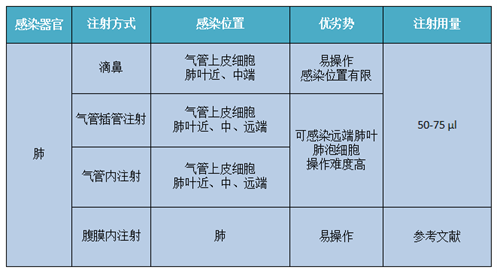
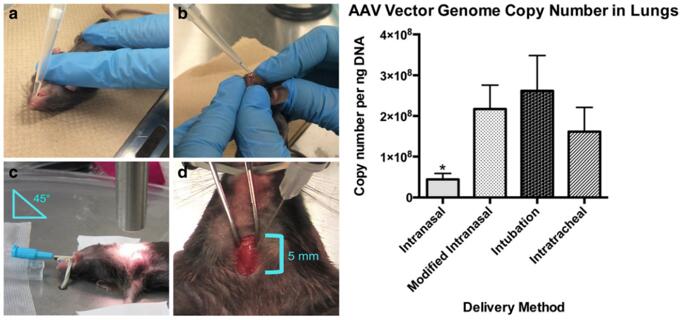
图10. 肺脏感染方式注射位置图(左:感染方式操作图;右:不同感染方式对应感染效果图)[13](PMID: 28506256)
【汉恒文献速览】 南京医科大学附属儿童医院赵德育教授和刘峰副教授团队研究结果发现lncRNA-AK007111通过调节肥大细胞相关功能在哮喘中发挥重要作用。文章中使用的AAV2/6-CMV-lncRNA-AK007111-ZsGreen病毒由汉恒生物提供[14]。
注射参数:
病毒类型:AAV2/6-CMV-lncRNA-AK007111-ZsGreen
病毒滴度:1.0×1012 vg/ml
目标部位:肺部
注射方法:气管插管注射
注射剂量:本文未明确标注。气管插管注射50 μL AAV6感染肺部(数据来源于该团队另外一篇文章PMID: 32929606,病毒均由汉恒生物提供)。
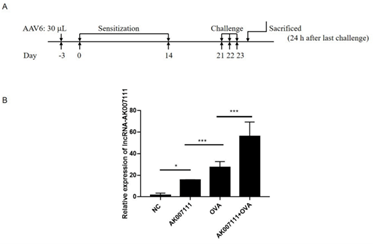
图11. AAV2/6-CCMV-lncRNA-AK007111对lncRNA-AK007111表达的上调[14](PMID: 37301118)
【汉恒文献速览】 上海市肺科医院刘锦铭、赵华琴、袁平团队共同发现circGSAP通过与miR-27a-3p竞争性结合增加BMPR2来减轻PMECs的功能障碍,并减轻MCT-PH大鼠的肺血管重塑,为特发性肺动脉高压(IPAH)提供了潜在的治疗策略。文章中使用的pHBAAV6-CMV-circGSAP-EF1-ZsGreen病毒由汉恒生物提供[15]。
注射参数:
病毒类型:pHBAAV6-CMV-circGSAP-EF1-ZsGreen
病毒滴度:1.1 × 1012 vg/mL
目标部位:肺部
注射方法:气管内注射
注射剂量:200 μL /每只大鼠。
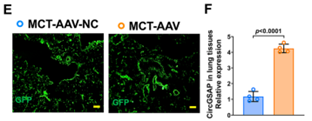
图12. AAV2/6在肺组织中调控circGSAP的高表达[15](PMID: 36403044)
【汉恒文献速览】 广东省细胞微环境与疾病研究重点实验室吴传跃教授团队发现由PINCH-1、DRP1和PYCR1组成的信号轴调节线粒体动力学和脯氨酸合成,并为减缓肿瘤生长提供了一种有吸引力的策略。文章中使用的Ad-Cre病毒由汉恒生物提供[16]。
注射参数:
病毒类型:Ad-Cre
目标部位:肺部
注射方法:滴鼻
注射剂量:将总体积为90 μL、剂量为3×107 pfu的Ad-Cre和CaCl2(终浓度为10 mM CaCl2)混合,制备磷酸钙沉淀中的腺病毒(Ad-Cre:CaPi共沉淀物)。将Ad-Cre:CaPi共沉淀物装载在移液管尖端中,并使用两次45 μL滴注以3 min间隔经鼻给药。
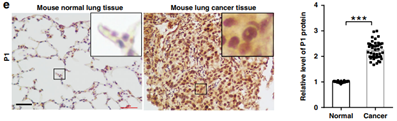
图13. 向KrasLSL−G12D/+小鼠的肺中施用Ad-Cre来诱导肺腺癌[16](PMID:33004813 )
【汉恒文献速览】 中国医科大学第一医院麻醉科于昉团队研究发现葛根素(PU)抑制了NLRP3炎症小体诱导的细胞焦下垂,以减轻急性肺损伤(ALI)。文章中使用的pLV-HDAC1、pLV-PP2A、pLV-IKZF1、和pLV-shPP2A病毒由汉恒生物提供[17]。
注射参数:
病毒类型:pLV-HDAC1、pLV-PP2A、pLV-IKZF1、和pLV-shPP2A
目标部位:肺部
注射方法:腹膜内注射
注射剂量:在ALI-PU治疗前6天,取小鼠并腹膜内注射基于慢病毒的oe-HDAC1和shPP2A。
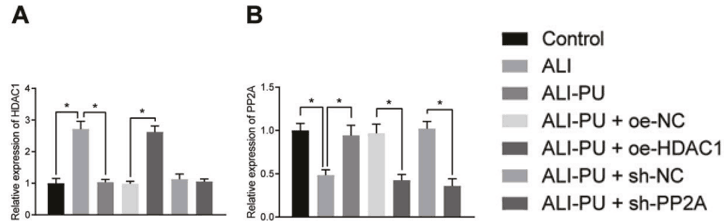
图14. PU、oe-HDAC1或sh-PP2A治疗后ALI小鼠肺组织中HDAC1和PP2A的表达[17](PMID: 35977927)
近几期文章相继与大家分享了内耳、肠道、子宫与胚胎以及肺组织(细胞)特异性调控干货知识。至此,我们的组织(细胞)特异性表达调控AAV系列干货知识就要暂告一段落了,欢迎大家继续订阅关注!
参考文献
[1] Ruge CA, Kirch J, Lehr CM. Pulmonary drug delivery: from generatingaerosols to overcoming biological barriers-therapeutic possibilities andtechnological challenges. Lancet Respir Med. 2013;1:402–13.17.
[2] Patel B, Gupta N, Ahsan F. Particle engineering to enhance or lessenparticle uptake by alveolar macrophages and to infuence the therapeutic outcome. Eur J Pharm Biopharm. 2015;89:163–74.
[3] He S, Gui J, Xiong K, Chen M, Gao H, Fu Y. A roadmap to pulmonary delivery strategies for the treatment of infectious lung diseases. J Nanobiotechnology. 2022 Mar 3;20(1):101.
[4] Shrestha J, Razavi Bazaz S, Aboulkheyr Es H, Yaghobian Azari D, Thierry B, Ebrahimi Warkiani M, Ghadiri M. Lung-on-a-chip: the future of respiratory disease models and pharmacological studies. Crit Rev Biotechnol. 2020 Mar;40(2):213-230.
[5] Meyer-Berg H, Zhou Yang L, Pilar de Lucas M, Zambrano A, Hyde SC, Gill DR. Identification of AAV serotypes for lung gene therapy in human embryonic stem cell-derived lung organoids. Stem Cell Res Ther. 2020 Oct 23;11(1):448.
[6] Excoffon KJ, Koerber JT, Dickey DD, Murtha M, Keshavjee S, Kaspar BK, Zabner J, Schaffer DV. Directed evolution of adeno-associated virus to an infectious respiratory virus. Proc Natl Acad Sci U S A. 2009 Mar 10;106(10):3865-70.
[7] Zincarelli C, Soltys S, Rengo G, Rabinowitz JE. Analysis of AAV serotypes 1-9 mediated gene expression and tropism in mice after systemic injection. Mol Ther. 2008 Jun;16(6):1073-80.
[8] Xu X, Yu T, Dong L, Glauben R, Wu S, Huang R, Qumu S, Chang C, Guo J, Pan L, Yang T, Lin X, Huang K, Chen Z, Wang C. Eosinophils promote pulmonary matrix destruction and emphysema via Cathepsin L. Signal Transduct Target Ther. 2023 Oct 11;8(1):390.
[9] Zhang L, Zeng XX, Li YM, Chen SK, Tang LY, Wang N, Yang X, Lin MJ. Keratin 1 attenuates hypoxic pulmonary artery hypertension by suppressing pulmonary artery media smooth muscle expansion. Acta Physiol (Oxf). 2021 Feb;231(2):e13558.
[10] McLachlan G, Alton EWFW, Boyd AC, Clarke NK, Davies JC, Gill DR, Griesenbach U, Hickmott JW, Hyde SC, Miah KM, Molina CJ. Progress in Respiratory Gene Therapy. Hum Gene Ther. 2022 Sep;33(17-18):893-912.
[11] Degiulio JV, Kaufman CD, Dean DA. The SP-C promoter facilitates alveolar type II epithelial cell-specific plasmid nuclear import and gene expression. Gene Ther. 2010 Apr;17(4):541-9.
[12] Wang H, Xu H, Lyu W, Xu Q, Fan S, Chen H, Wang D, Chen J, Dai J. KLF4 regulates TERT expression in alveolar epithelial cells in pulmonary fibrosis. Cell Death Dis. 2022 May 4;13(5):435.
[13] Santry LA, Ingrao JC, Yu DL, de Jong JG, van Lieshout LP, Wood GA, Wootton SK. AAV vector distribution in the mouse respiratory tract following four different methods of administration. BMC Biotechnol. 2017 May 15;17(1):43.
[14] Xu J, Zhang S, Li H, Bao Y, Du Y, Zhou Y, Zhao D, Liu F. LncRNA-AK007111 affects airway inflammation in asthma via the regulation of mast cell function. Int Immunopharmacol. 2023 Aug;121:110341.
[15] Sun Y, Jiang R, Hu X, Gong S, Wang L, Wu W, Li J, Kang X, Xia S, Liu J, Zhao Q, Yuan P. CircGSAP alleviates pulmonary microvascular endothelial cells dysfunction in pulmonary hypertension via regulating miR-27a-3p/BMPR2 axis. Respir Res. 2022 Nov 19;23(1):322.
[16] Guo L, Cui C, Wang J, Yuan J, Yang Q, Zhang P, Su W, Bao R, Ran J, Wu C. PINCH-1 regulates mitochondrial dynamics to promote proline synthesis and tumor growth. Nat Commun. 2020 Oct 1;11(1):4913.
[17] Cai D, Zhao Y, Yu F. Puerarin ameliorates acute lung injury by modulating NLRP3 inflammasome-induced pyroptosis. Cell Death Discov. 2022 Aug 18;8(1):368.

查看更多

查看更多

查看更多

联系我们

返回顶部