查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息
T细胞(T cell、T淋巴细胞/T lymphocyte)是淋巴细胞的一种,在免疫反应中扮演着重要的角色。T细胞在胸腺内分化成熟,成熟后移居于周围淋巴组织中。随着细胞免疫治疗的日益深入,T细胞的基因工程化改造显得越来越重要。

然而,T细胞的基因操作却异常困难,普通的DNA质粒根本就转不进去,即使是病毒介导的基因转染操作,也有不少难题,主要体现在几个方面:
1.常规的慢病毒,由于T细胞膜上受体的不稳定;非激活的T细胞本身无增殖能力;T细胞内部有阻碍反转录的机制等原因而导致慢病毒的T细胞感染能力 偏弱,需要多次重复感染,且对于实验操作的条件要求十分苛刻
2.体外培养的T细胞本身十分敏感且脆弱,慢病毒感染对细胞的状态影响非常大
3.T细胞是悬浮细胞,进一步增大了病毒感染的难度
遇上这样“磨人的细胞”怎么办?
汉恒生物独家研发了2种适用于原代T细胞的常用病毒——逆转录病毒(mTRv和hRv)和悬浮细胞专用的腺病毒(Ads)
逆转录病毒感染细胞具有物种特异性,适用小鼠原代T细胞的为mTRv,适用人原代T细胞的为hTRv。逆转录病毒可以用来构建稳转系。
专用腺病毒Ads不区分物种,对人、小鼠等物种的原代 T 细胞均具有很高的感染效率,另外,Ads也非常适用感染其他悬浮细胞,如Jurkat,K562,HL-60和L1210等。
细胞转染主要分三个步骤:细胞制备、细胞体外刺激、细胞感染。
一、细胞制备
小鼠脾脏细胞悬液制备
1. 脱颈处死小鼠,腹部朝上正体位暴露小鼠右侧腹部。
2. 75% 乙醇消毒,剪开腹部切取脾脏。
3. 将脾脏放入预先放置好cell strainer(FALCON,352350)并已加入5ml无菌PBS的六孔板或培养皿中。
4. 用无菌注射器柄充分研磨脾脏。
5. 弃掉 cell strainer,轻柔吹打细胞至充分重悬,收集到一无菌15ml离心管中,于4℃400g,离心5min。(注:一旦取出脾脏,请置于冰上操作)
6.将第5步离心后弃上清的脾脏细胞用5ml无菌ACK裂解液轻柔充分吹打混匀,于冰上裂解5min。(注:ACK裂解液配方如下表,配好之后用0.22μm的滤膜过滤,4℃保存不超过1月)
7.裂解结束后加入10ml无菌PBS终止裂解反应,于4℃400g离心5min。
8.弃上清,用10ml无菌PBS洗一次,弃上清后直接加入培养基重悬计数,一只脾脏可得3-10x107个细胞。(注:如果要进行下一步的分离CD4+T细胞操作,请直接按照说明书将细胞重悬在合适体积的PBS中)
人 PBMC 细胞制备
1.取一15ml离心管,加入2ml已用抗凝剂处理过的人血液样品,再加入等体积的PBS进行稀释(终体积4 ml)。(注:若为经过处理的浓缩血液样品,请按照新的稀释倍数合理稀释。为了保证分离细胞的活力和效率,请使用新鲜血液,血液样品请于18~20℃ 保存)
2.上下颠倒或用枪混匀样品,备用。
3.上下翻转确保Ficoll-PaquePLUS(GE)分离液彻底混匀,去掉聚丙烯瓶盖,使用注射器针头插入瓶塞吸取3ml分离液(注:分离之前请将Ficoll-Paque PLUS分离液预热至18~20℃)
4.取一新的无菌15ml离心管,加入3ml步骤3中取出的分离液。
5.小心加入稀释好的 4 ml 血液样品,不要打破 Ficoll-Paque PLUS 液面(注:可将离心管倾斜至与水平台面呈 30°,缓慢沿管壁加入血液样品)
6.将离心管小心竖直放入离心机内,于 18~20℃,400 g 离心 30~40 min(注:特别注意将离心机的降速加速度调到 0)
配制500ml 1*ACK buffer

7.小心取出离心管。此时液体分为 3 层,中层为分离液层,最下层为红细胞,最上层为血浆。位于中层靠近血浆层的白膜层即为单个核细胞层,小心吸走血浆层,不要打动白膜层。(注:可吸出最上层的血浆层保存以备后续使用)
8.用无菌移液枪将白膜吸到一新的离心管中。
9.用三倍体积(约 6 ml)的无菌 PBS 重悬步骤 7 中的 PBMC,重悬时用枪轻柔吹散,于 18~20℃,400 g 离心 10~15 min,重复一次,最后用培养基重悬备用,多余的 PBMC 可以冻存继续使用。(注:在较高的离心速度下(400~500 g)可以提高 PBMC 的得率,同时需注意在较低的离心速度下(60~100 g)可以分离掉不需要的血小板。另外如上操作和比例适用于更大体积的分离)
二、细胞体外刺激
CD4+ T 细胞体外刺激
1. 按照小鼠或人源 CD4+T 细胞分离 kit (Thermo) 说明书分离得到 CD4+T 细胞。
2. 取所需体积的 PBS,按照 5 μg/ml 的终浓度加入 Anti-mouse CD3e 和 Anti-mouse CD28 抗体,500 μl/孔包被 Non-Treated 24-well plate,室温放置 4 h,吸掉抗体悬液,加入 500 μl 1% BSA(PBS 配置)室温封闭 30 min,封闭结束加入 500 μl PBS 洗孔一次(注:请在分离细胞的同时准备好平板,包括后续感染所需的量)
3.将分离得到的 CD4+ T 按照浓度 5x105 cell/ml 重悬在完全 T 细胞培养基中(1640,10% FBS,1% penicillin-streptomycin, 50 μM β-mercaptoethanol, 100 U/ml IL-2),将细胞加入步骤 2 中包被处理好的平板,2 ml 每孔(1x106 cell/well),然后放入 37℃ CO2培养箱刺激培养 48 h。细胞在刺激 24 h 后体积略微增大,进入活化状态,刺激 48 h 后可进行病毒感染。
三、细胞感染
CD4+ T 细胞感染(以过表达 GFP 的病毒为例)
1. 收集活化好的 CD4+T 细胞,400 g 离心 5 min。用 T 细胞培养基重悬计数备用,在收集的过程中发现有些细胞会贴壁,此为正常现象,可反复吹打至贴壁的细胞也呈悬浮状态。
2. 另取一 Anti-mouse CD3e 和 Anti-mouse CD28 抗体包被好的 24 孔板,每孔加入 2-5x105 的细胞(若为 96 孔板,加入 2x104 细胞/孔)。若考虑长期表达目的基因,按 MOI=50-100 加入汉恒生物 T 细胞专用逆转录病毒 mTRv-GFP 或者 hTRv-GFP,注意鼠源和人源原代 T 细胞所适合的逆转录病毒种类差别;若考虑瞬时(一周以内)表达目的基因,可按 MOI=500-1000 加入汉恒悬浮细胞专用腺病毒 Ads-GFP。同时加入 polybrene 至终浓度 6 g/ml,最终感染体积为 500 μl,加入病毒后轻轻吹打混匀(注:具体 MOI 选择可在 96 孔板中预实验进行梯度摸索,对于逆转录病毒建议使用 10,30,100 的梯度进行,对于腺病毒建议使用 500,1000,1500 的梯度进行摸索)
3. 24-well plate 于 1000 g 室温离心感染 90 min。离心结束后将平板放入 37℃ CO2 培养箱感染 6 h(注:离心结束观察细胞分散状态,除非细胞全聚集在一处,否则不建议吹散细胞)
4. 感染结束后取出培养板,小心吸掉感染孔中 350 μl 的培养基(70%),加入 1.85 ml 的 T 细胞完全培养基补足体积为 2 ml 并吹打混匀。
5. 可选步骤:病毒感染 24 h 后,小心吸掉培养基,在同一培养皿中按照 2-4 步进行病毒复感染操作。
6. 将细胞放入 37℃ CO2 培养箱继续培养,2~3 天后可观察荧光,做流式检测感染效率。正常情况下,汉恒生物提供的 T 细胞专用逆转录病毒(mTRv 和 hTRv)和悬浮细胞专用腺病毒(Ads)感染原代 T 细胞的效率大于 50%。(注:感染后刺激的细胞增殖较快,请注意观察细胞密度并使其维持在 1x106/ml 左右。此外,如果需要让细胞增殖较长时间,为了防止其过度活化,可撤掉抗体的刺激)
五、慢病毒感染T细胞感染实例
细胞:人原代CD4+ T细胞
刺激方式:CD3/CD28抗体和IL-2激活48h
病毒:hTLv-GFP慢病毒, 1*108 TU/ml
使用方式:MOI=50
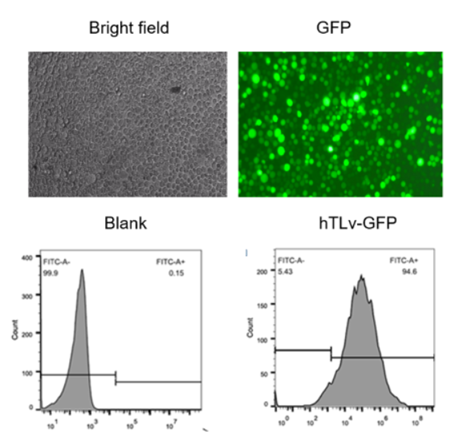
图1.慢病毒感染人原代CD4+ T细胞

查看更多

查看更多

查看更多

联系我们

返回顶部