查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息
在我们前几期的干货中,为大家介绍了胰腺、内耳等组织的靶向调控策略,本期将为大家带来AAV在肠道研究中的靶向策略。

肠道是人体重要的消化器官,也是人体最大的排毒器官。同时也是重要的免疫器官,有70%以上的免疫细胞分布在肠黏膜上,担负着重要的免疫功能。肠指的是从胃幽门至肛门的消化管,也是功能最重要的一段。哺乳动物的肠包括小肠和大肠。大肠是消化管的下段,全程围绕于空、回肠的周围,可分为盲肠、阑尾、结肠、直肠和肛管五部分(图1)。小肠是消化管中最长的一段,上端起于胃幽门,下端接续盲肠,分十二指肠、空肠和回肠三部分(图2)。
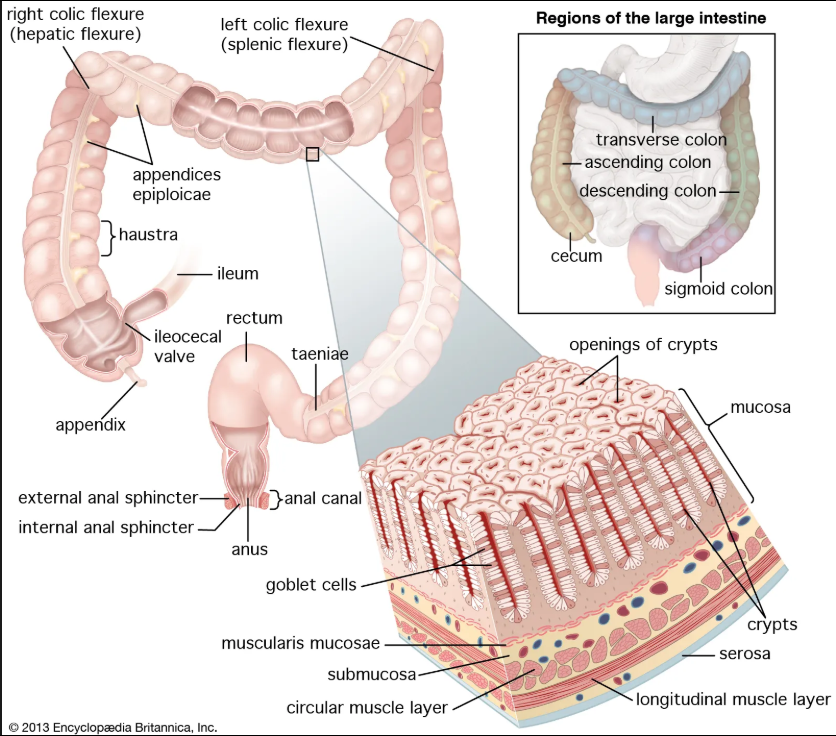
图1. 大肠、直肠和肛门的结构
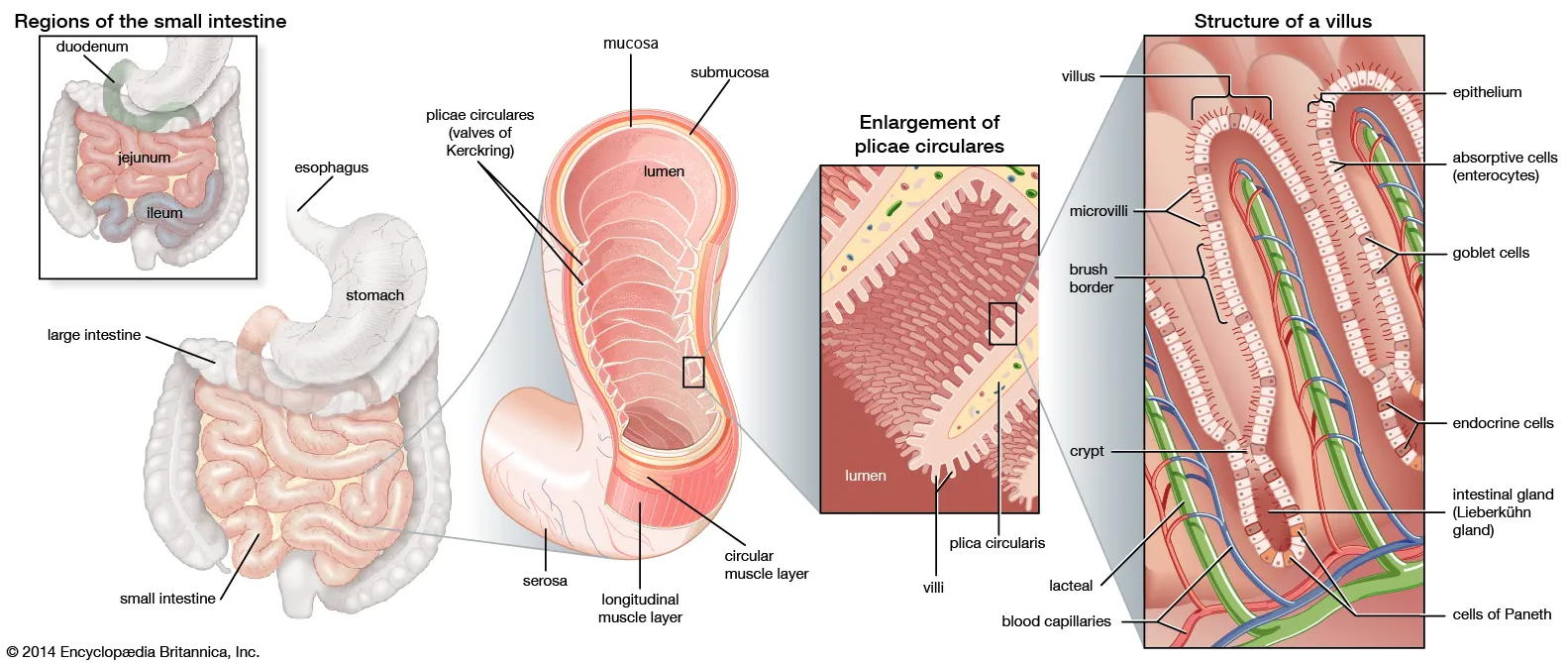
图2.小肠的结构
对于肠道的早期研究主要集中在肠粘膜转导上,由于肠道结构的复杂性导致其转导效率不高。目前功能性胃肠研究和临床胃肠病学面临的主要挑战之一是如何特异性靶向胃肠道中的细胞亚型。转基因动物虽然是有价值的研究工具,但灵活性不强,并且周期长、成本高。重组腺相关病毒(recombinant adeno-associated virus,rAAV)是一种非致病性病毒载体,既能感染分裂细胞,又能将基因递送到非分裂细胞,是常用的基因治疗载体,具有宿主广、表达时间长、安全性高等特点。rAAV有数十种血清型,能够特异性的感染不同的组织或者器官。本期我们将目标聚焦于肠道靶向性AAV的选择,从血清型、启动子选择及注射方式三个方面和大家一起探讨AAV在肠道疾病研究中的靶向递送策略。
一、血清型和启动子选择
rAAV的血清型由衣壳蛋白决定,不同的血清型对AAV的感染倾向有很大的影响,根据自己的实验需求选择合适的血清型是决定实验效果的重要影响因素。在首次发现AAV2并研究和改造后,研究者陆续发现数十种野生血清型,并在其基础上进行衣壳蛋白Cap基因的改造开发出新的血清型以提高对不同组织的靶向性。各种血清型对肠道的转导效率也有不少探索,如Steven P等人通过三种不同的给药方式对rAAV1-10进行评估,来确定在小肠(SI)和结肠中转导效率最佳的血清型,结果表明AAV7、AAV8、AAV9和AAV10对肠道组织的转导效率较高(图3)[1],其中AAV7对小肠的感染效率相对较高,而在结肠中AAV8和AAV9的转导效率更好,结肠目前研究中应用较多的血清型是AAV9。
肠道研究中,启动子通常选择广谱型启动子CMV、EF1α、CAG等;当然,如果是研究肠道神经系统,也会用到神经细胞的特异性启动子,比如GFAP。
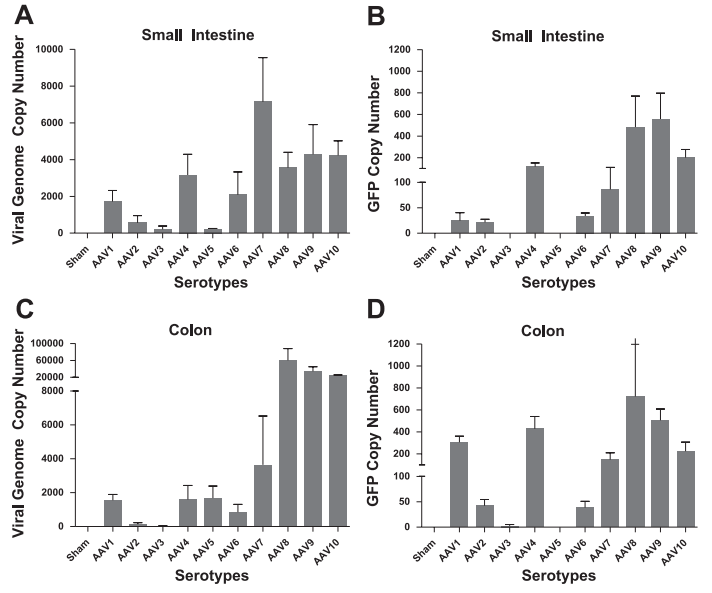
图3. SMA注射AAV后不同血清型在小肠(SI)和结肠中转导效率对比
Roeland Buckinx等根据前人的研究,对AAV在胃肠道中的应用进行了综述[2]。Shao[3]和Polyak[4,5]等为了转导肠黏膜,用AAV1/2/5型经灌胃、灌肠和腹腔注射给药,发现成功率都比较低。经肠系膜上动脉给药,AAV8、9和10的转导效率较好。Benskey等人[6]在对AAV不同血清型靶向肠神经系统的比较中发现,在大鼠肠壁内注射AAV6和AAV9后,能有些转导肌肠丛和粘膜下丛。下表总结了不同血清型AAV通过不同给药方式靶向肠道不同部位的转导效率:
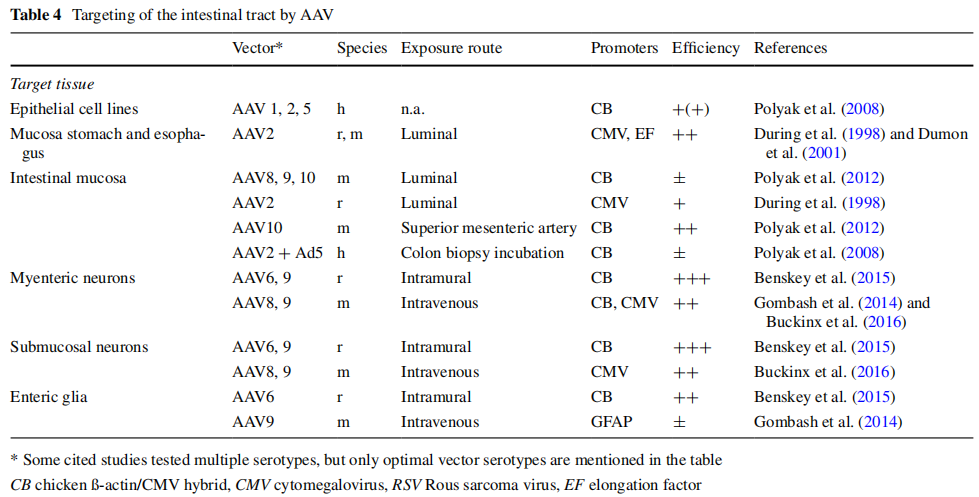
二、注射方式
感染肠道常见的注射方式有尾静脉注射、腹腔注射、灌肠和肠系膜上动脉(SMA)注射等[4,7]。其中尾静脉注射和腹腔注射是系统性给药,虽然这两种注射方式特异性相对较差,但因其操作简单、损伤性小,所以在文献中比较常见,腹腔注射是目前用得比较多的一种方式。图4是使用AAV9腹腔注射200ul感染结肠的效果[8]。而灌肠和SMA这两种注射方式的感染效果较好但操作相对比较繁琐,本文将详细介绍这两种感染方法。
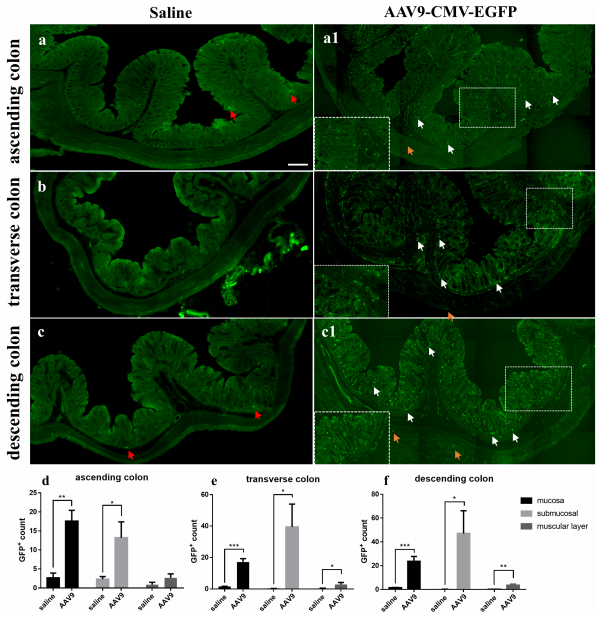
图4. AAV9腹腔注射后转导效率
灌肠[1]:注射病毒前先小鼠过夜禁食并麻醉,之后在直肠注射300ul 20mM的NAC清洗结肠30min。再次麻醉小鼠,然后将聚乙烯软管插入距离离肛门4厘米深的小鼠结肠部位,使用注射器缓慢注入适量的病毒(通过灌肠给予小鼠200μL AAV,推荐注射剂量至少4×10^10 vg/只)。注射完毕后,将小鼠在垂直倒立状态保持1分钟以上,以确保病毒在结肠部位的均匀分布。图5是通过灌肠给药的方式,注射AAV9-miR-199a-5p-sponge来抑制miR-199a-5p的表达,缓解溃疡性结肠炎[9]。
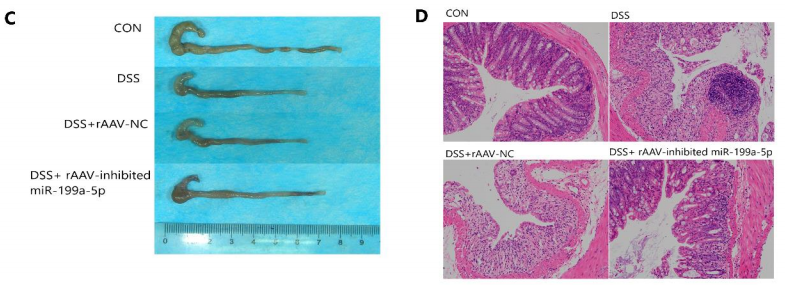
图5.抑制miR-199a-5p减轻DSS诱导的溃疡性结肠炎
肠系膜动脉(SMA)注射[7]:固定小鼠并麻醉,沿着腋线和侧腹,在脾脏区域的左侧皮肤上开一个1-2 cm的切口,切开腹外斜肌,使用微型牵引器将皮肤和腹壁固定,暴露SMA。将SMA从腹膜后剥离,在SMA的近端接头周围放置一个小的稳定接头连接注射针,使用微血管夹暂时切断腹主动脉的血液供应。将33号1/2针头连接到250μl汉密尔顿TLL气密性进样针注射器轻轻插入SMA进行病毒注射(200μL体积的AAV,推荐注射剂量至少5×10^10vg/只)。将固定带轻扎血管,防止注射部位泄漏,另外注射过程中可使用显微镜观察以确保注射可视准确。
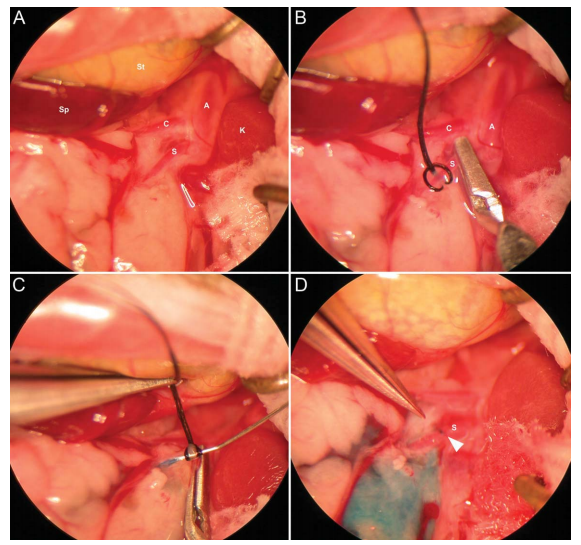
图6. SMA注射示意图
最后对肠道系统AAV注射方式及剂量进行总结,并附上注射视频供大家参考:
表1:肠道注射方式与剂量参考
| 注射方式 | 感染范围 | 注射剂量 | 视频教程 |
|---|---|---|---|
| 尾静脉注射 | 全身大部分器官,血液系统 | >1E11vg/只小鼠100uL | https://www.jove.com/cn/v/61961/a-contemporary-warmingrestraining-device-for-efficient-tail-vein |
| 腹腔注射 | 腹腔肠道 | >1E11vg/只小鼠100-200uL | https://www.bilibili.com/video/BV1q7411y7fS/?spm_id_from=333.999.0.0&vd_source=43ab5539ff4b103665aeb9d18e229474 |
| 灌肠 | 结肠 | >4E10vg/只小鼠200uL | https://www.bilibili.com/video/BV1Yb41197h6/?spm_id_from=333.337.search-card.all.click&vd_source=43ab5539ff4b103665aeb9d18e229474 |
| SMA注射 | 小肠,结肠(可感染上皮细胞) | >5E10vg小鼠100-200uL | https://www.jove.com/cn/v/60787/targeting-rat-s-small-bowel-long-term-infusion-into-superior |
本期干货内容为大家介绍了感染肠道的血清型/启动子的选择、病毒的注射方法,希望能对正在做肠道方面实验的老师提供一些参考。汉恒生物还研发了靶向神经、肌肉、肾脏、肝脏、视网膜等组织器官的AAV特异性启动子和特异性血清型,欢迎各位老师同学来电咨询,热线:400 092 0065。
本期内容到这里就结束了,下期我们将会继续分享在子宫方面的特异性基因调控策略,敬请关注。
参考文献:
[1] Steven P , Annette M , Stacy P , et al. Identification of adeno-associated viral vectors suitable for intestinal gene delivery and modulation of experimental colitis[J]. American Journal of Physiology Gastrointestinal & Liver Physiology, 2012, 302(3):296-308.
[2] Buckinx R , Timmermans J P . Targeting the gastrointestinal tract with viral vectors: state of the art and possible applications in research and therapy[J]. Histochemistry & Cell Biology, 2016, 146(6):1-12.
[3] Shao G, Greathouse K, Huang Q et al. Gene transfer to the gastrointestinal tract after peroral administration of recombinant adeno - associated virus type 2 vectors. J Pediatr Gastroenterol Nutr, 2006, 43:168–179.
[4] Polyak S, Mah C, Porvasnik S et al. Gene delivery to intestinal epithelial cells in vitro and in vivo with recombinant adeno-associated virus types 1, 2 and 5. Digestive Diseases and Sciences, 2008, 53(5):1261-1270.
[5] Polyak S, Mach A, Porvasnik S et al. Identification of adeno-associated viral vectors suitable for intestinal gene delivery and modulation of experimental colitis. Am J Physiol Gastrointest Liver Physiol, 2012, 302:G296–G308.
[6] Benskey MJ, Kuhn NC, Galligan JJ et al. Targeted gene delivery to the enteric nervous system using AAV: a comparison across serotypes and capsid mutants. Mol Ther 2015, 23:488–500.
[7] Porvasnik S L , Mah C , Polyak S .Targeting murine small bowel and colon through selective superior mesenteric artery injection[J].Microsurgery, 2010, 30(6):487-493.
[8] Wang J J, Li Y Q et al.Adeno-associated virus vector intraperitoneal injection induces colonic mucosa and submucosa transduction and alters the diversity and composition of the faecal microbiota in rats. Front. Cell. Infect. Microbiol. 2022. 12:1028380.
[9] Luo H S et al. Suppression of miR-199a-5p alleviates ulcerative colitis by upregulating endoplasmic reticulum stress component XBP1.bioRxiv, 2021 - biorxiv.org.

查看更多

查看更多

查看更多

联系我们

返回顶部