查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息
肝细胞癌(hepatocellular carcinoma,HCC),作为一种强侵袭性、高死亡率的原发性肝癌,是肝癌的主要组织学亚型,占原发性肝癌的90%,成为全世界癌症相关死亡率的第三大病因。免疫检查点抑制剂(ICIs)因其丰富的淋巴细胞浸润能力而成为治疗HCC的一种极具前景的有效方法,ICIs的批准上市预计有望改变晚期HCC的管理,但有研究表明ICI治疗对患者的总存活率(OS)并未显示出统计学上的显著改善。其中,HCC的ICI耐药性是由多方面共同作用的结果,其关键因素是肿瘤微环境(TME)内部复杂的细胞相互作用。因此,HCC免疫治疗抵抗的分子机制亟待解析,用以开发有效改善OS的治疗新策略。

2024年5月,天津医科大学于津浦和李祥春作为共同通讯作者在《Cell Reports Medicine》(IF=14.3)上发表了题为“Macrophagecoated tumor cluster aggravates hepatoma invasion and immunotherapy resistance via generating local immune deprivation”的研究论文。据研究表明肿瘤相关巨噬细胞(TAM)在HCC的TME中普遍存在,且促进免疫抑制环境的形成,较高的TAM密度与预后不良和ICI耐药性增加相关。在本研究中,作者通过采用先进的高复合分子谱分析发现了一种称为巨噬细胞包被肿瘤簇(macrophage-coated tumor cluster,MCTC)的独特空间结构组织,并发现MCTC与预后不良及肿瘤侵袭性密切相关。从机制上讲,肿瘤来源的巨噬细胞相关凝集素Mac-2结合蛋白(M2BP)诱导了MCTC的形成,并将免疫活性细胞困于MCTCs的边缘,从而诱导肿瘤内的细胞毒性T细胞排斥和局部免疫剥夺。因此,用Mac-2拮抗剂阻断M2BP可能是预防MCTC形成、增强T细胞浸润、进而提高HCC靶向ICI疗效的有效途径。在本研究中,作者使用了汉恒生物提供的敲低及过表达慢病毒调控人白血病单核细胞系THP-1、肝癌细胞系MHCC97L和MHCC97H以及小鼠肝癌细胞系Hepa1-6中M2BP基因的表达,并成功建立了敲低和过表达的稳定细胞系。
下面我们一起来看看作者是如何发掘其中的机制:
1. MCTC可作为侵袭性HCC的生物标志物和治疗策略的潜在靶点
作者首先采用多光谱免疫荧光(mIF)染色对不同HCC癌组织样本进行了TAM空间异质性及患者生存率相关性分析。结果显示这些HCC样本中出现了4种不同的TAM空间定位(SP)模式:少量TAM分散于肿瘤细胞中(TAM-LD)、少量TAM围绕肿瘤簇(TAM-LS)、大量TAM分散于肿瘤细胞中(TAM-HD)以及大量TAM围绕肿瘤簇(TAM-HS,这种空间组织结构被作者命名为MCTC)。结合临床结果发现TAM-HS模式患者的无复发生存期(RFS)和OS率最低,表明TAM SP模式是预测HCC复发和患者预后的重要指标。随后作者通过全切片成像技术发现MCTCs普遍存在于组织切片的各个部位,并发现肿瘤边缘的0-10 μm距离内的TAM数量及MCTC中TAM与肿瘤细胞的比值(M:T)对患者的RFS和OS有重要影响:TAMs的最佳切断量为4,最佳切断比为1:2,结合这两个参数预测HCC复发的效率最高,准确率为74.4%。作者将MCTC+ HCC定义为至少4个TAM周围有一个以上肿瘤簇且M:T比大于1:2的HCC病例。通过分析更多的HCC样本发现MCTC与肿瘤大小、微血管侵袭和卫星结节增加以及巴塞罗那临床肝癌(BCLC)分级相关。这些结果表明,MCTC不仅与HCC细胞的侵袭性和转移潜力增强有关,而且在推动HCC的恶性进展中起着关键作用,证实了MCTC作为侵袭性HCC生物标志物和治疗策略靶点的潜力。
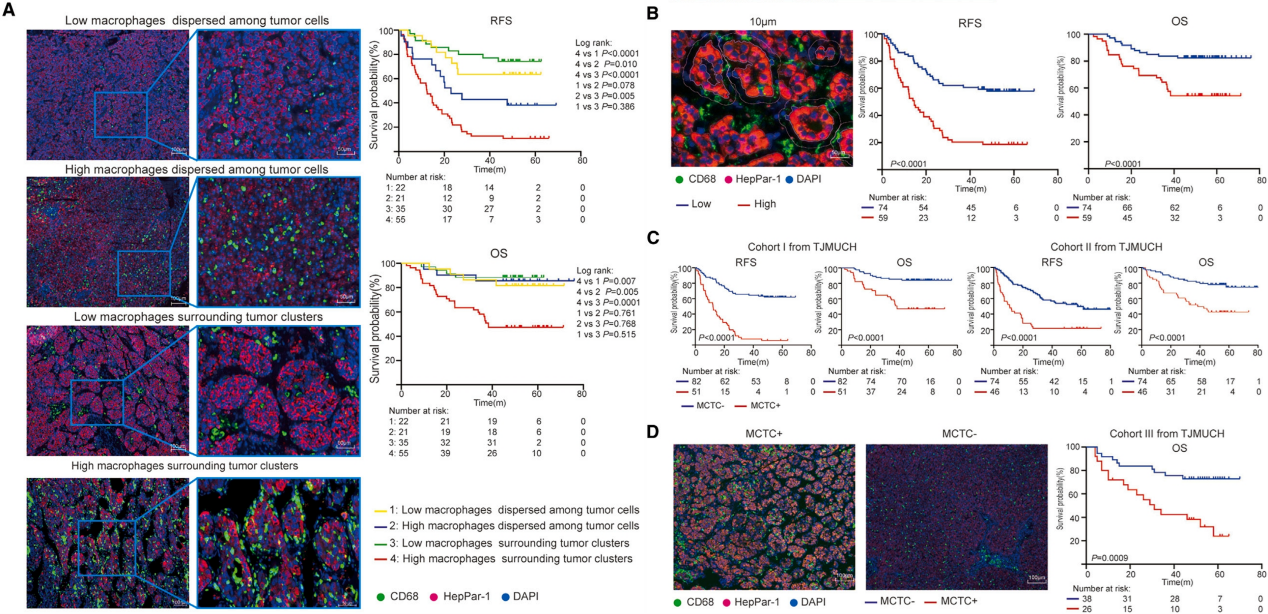
图1. HCC组织的MCTC与其侵袭性和患者不良预后相关
2. MCTC可预测HCC患者对ICI治疗的不良反应
基于MCTC+ HCC组织中密集的TAM浸润,作者紧接着评估了MCTC对HCC患者ICI反应的预测能力。通过全面的免疫调节基因特征分析,发现MCTC+ HCC患者对ICI治疗存在潜在不良反应,接受ICI治疗的HCC群体临床数据证明MCTC+ HCC中存在极大比例(客观缓解率28.57%)的ICI耐药。对免疫细胞分布的调查显示,MCTC+样本中CD8+ T细胞显著增加,但均位于MCTC周围,而非肿瘤巢内,表明TAMs在MCTC中起着隔离细胞毒性T细胞的关键作用,从而降低了ICI治疗的有效性。接着作者采用了深度学习人工智能(AI)成功对MCTC+和MCTC-进行了准确区分,表明可以通过图像聚类可靠地识别MCTC,AI可能成为未来临床环境中识别MCTC和预测ICI治疗反应的强大工具。
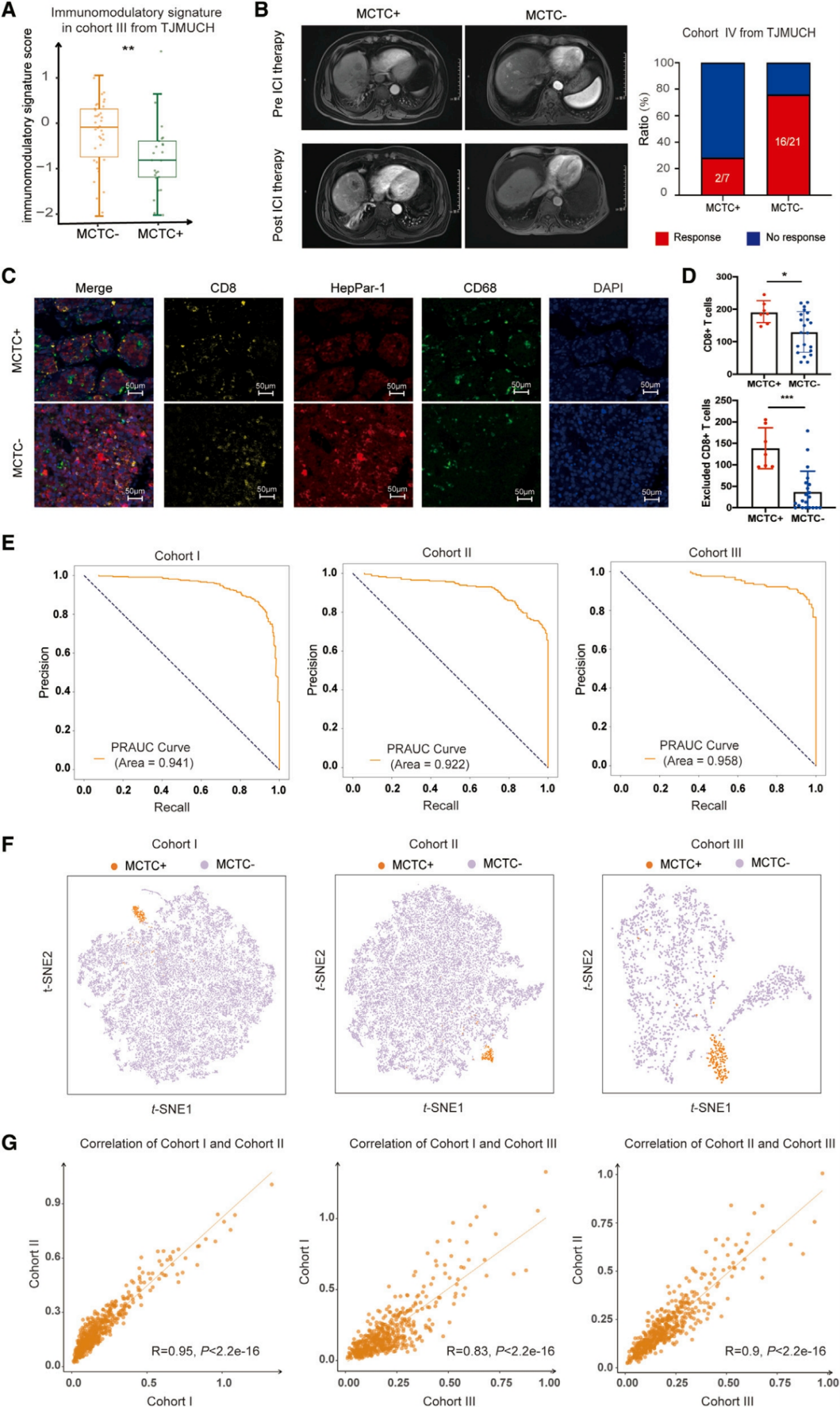
图2. MCTC可预测HCC患者对ICI治疗的不良反应
3. MCTC+ HCC中大量免疫活性细胞无法浸润至癌细胞中心
为了探索MCTC促进癌细胞转移的分子动力学基础,作者采用空间转录组技术分析了MCTC+ HCC和MCTC- HCC之间的分子表达差异,在CD68+巨噬细胞和panCK+肿瘤细胞区域共检测到1812个基因和55个蛋白,且MCTC+ HCC的CD68+巨噬细胞免疫相关通路基因mRNA水平较MCTC- HCC显著上调,另外细胞分析显示免疫活性细胞显著增加,表明MCTC+ HCC中的免疫应答增强,符合“免疫热肿瘤”(免疫细胞浸润量大)的特征。随后,作者进一步确定了免疫细胞存在的位置:CD68+巨噬细胞聚集区域(AOIs),而非panCK+肿瘤细胞AOIs,表明尽管MCTC+ HCC的特征是热肿瘤,但大量免疫活性强的细胞被隔离在MCTC外,阻碍了其向肿瘤核心的浸润。
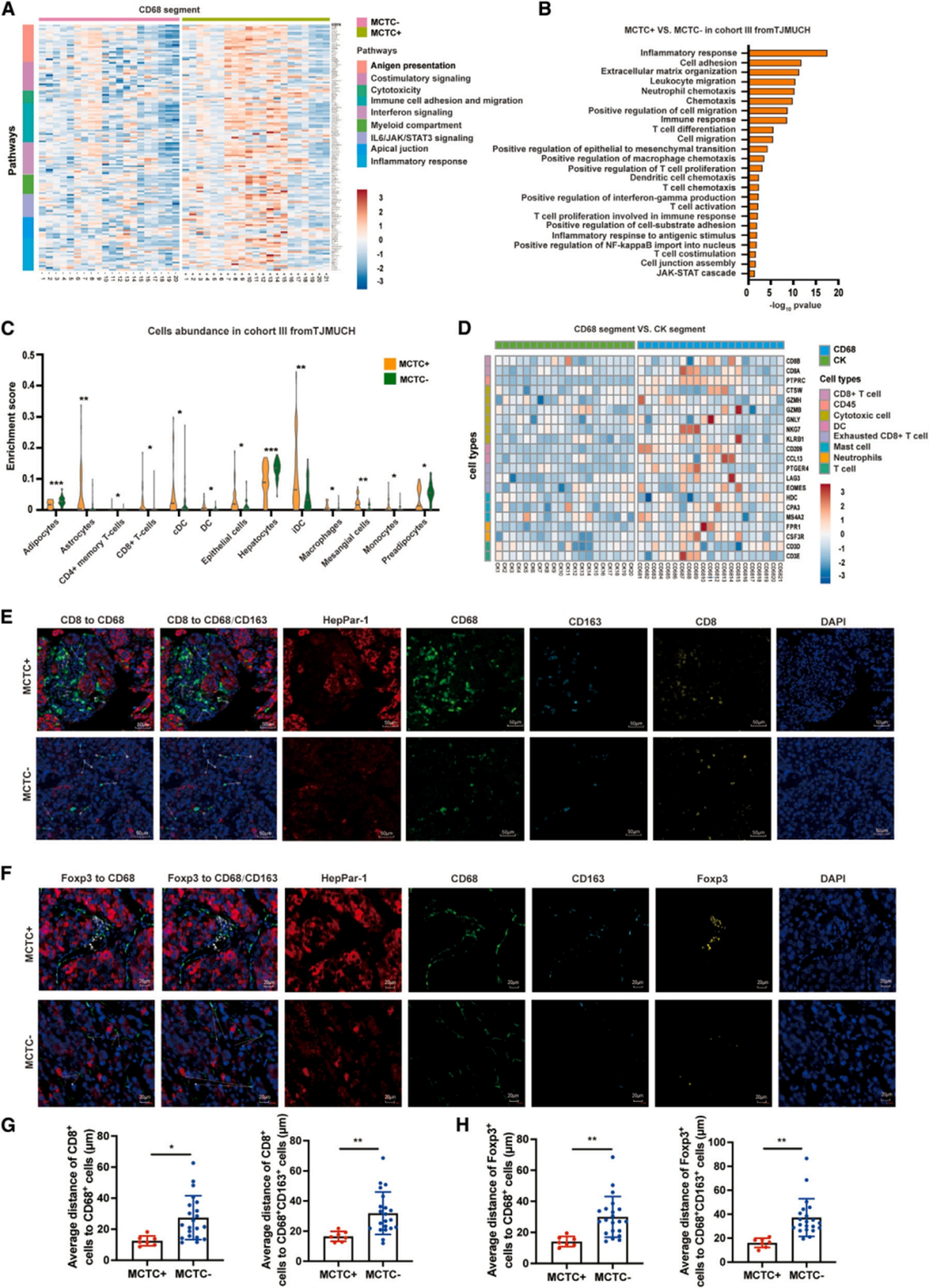
图3. MCTC+ HCC的免疫活性细胞无法浸润至肿瘤核心
4. MCTC+ HCC中的巨噬细胞表现出明显的免疫抑制和促肿瘤表型
在确认MCTC+ HCC免疫细胞的浸润情况后,作者对TME中的细胞进行了单细胞RNA测序(scRNA-seq),发现MCTC+ HCC中存在一种特殊的巨噬细胞表型。这种表型与脂质相关(LA -TAM)、免疫调节(Reg -TAM)和促血管生成(Angio-TAM)表型表现出相关的特征,这些巨噬细胞通过促进免疫逃避、提供营养和满足癌细胞的代谢需求参与肿瘤的发生。对比分析显示,这些TAM亚群在MCTC+ HCC巨噬细胞中的比例显著上调,激活了促进细胞迁移、血管生成等信号通路,表明MCTC+ HCC的巨噬细胞表现出明显的免疫抑制和促肿瘤表型。另外,与ICI耐药性显著关联的免疫抑制性Trem2+肿瘤浸润巨噬细胞被发现主要出现在前述的特殊巨噬细胞集群中,在MCTC+ HCC组织中十分丰富。而在免疫应答中发挥重要作用的Tregs和耗竭T细胞数量则与Trem2+巨噬细胞比例成正相关,提示MCTC+ HCC的Trem2+巨噬细胞可能通过诱导Treg扩增和T细胞衰竭触发免疫抑制微环境,降低细胞毒性T细胞的抗肿瘤作用。
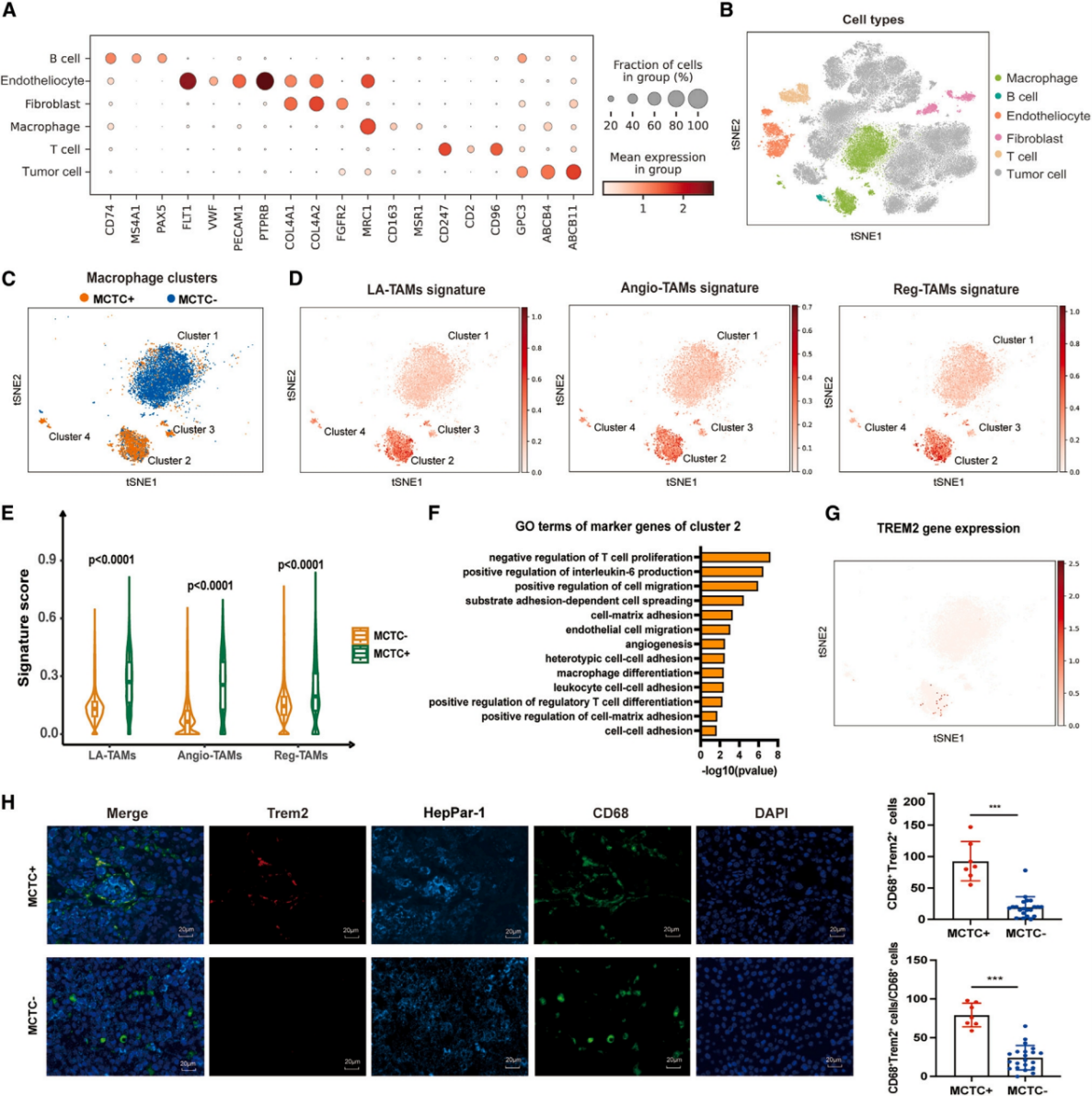
图4.MCTC+ HCC巨噬细胞出现明显的免疫抑制和促肿瘤表型
5. 肿瘤源性M2BP增强了趋化性和细胞间粘附,诱导MCTC在体内和体外形成
MCTC+ HCC组织中的细胞表型得到验证后,作者研究了MCTC+ HCC中肿瘤细胞与微环境之间的相互作用,结果显示MCTC+ HCC的panCK+肿瘤细胞区域中一些对免疫细胞粘附和迁移至关重要的信号通路明显被激活,表明区域内细胞间黏附更强。为了深入研究MCTC+ HCC中细胞-细胞粘附的分子机制,作者进行了全基因组基因表达谱分析。结果显示LGALS3BP(M2BP)在MCTC+ HCC中的表达量显著增加,且仅限于HepPar-1+细胞(癌细胞)。随后功能分析显示,M2BP在高转移HCC细胞系(MHCC97H)中的沉默降低了巨噬细胞的趋化性和粘附性,在低转移细胞系(MHCC97L)中的过表达则增强了这些特性。而Mac-2拮抗剂GB1107可有效抑制这些过程。在成功移植过表达M2BP的Hepa1-6细胞(Hepa1-6M2BPhi)的小鼠模型中也证实了上述结果:M2BP过表达促进MCTC的形成和MCTC周围CD8+ T细胞的隔离,而用GB1107治疗可有效地破坏这一过程,减少肿瘤负荷和转移。通过流式细胞术分析,作者发现与对照组相比,M1极化巨噬细胞显著减少,而Mac-2+细胞、Trem2+ M2极化巨噬细胞、Tregs和T细胞的数量显著增加,呈现衰竭表型。相反,GB1107治疗显著减少了Mac-2+巨噬细胞浸润,逆转M2极化,减少Trem2+ M2亚群、Treg和耗竭T细胞的数量,意味着免疫反应的重新激活。上述结果表明M2BP参与HCC中免疫抑制生态位的形成,而GB1107干预可破坏MCTC的形成,减弱免疫抑制环境,增强抗肿瘤免疫。
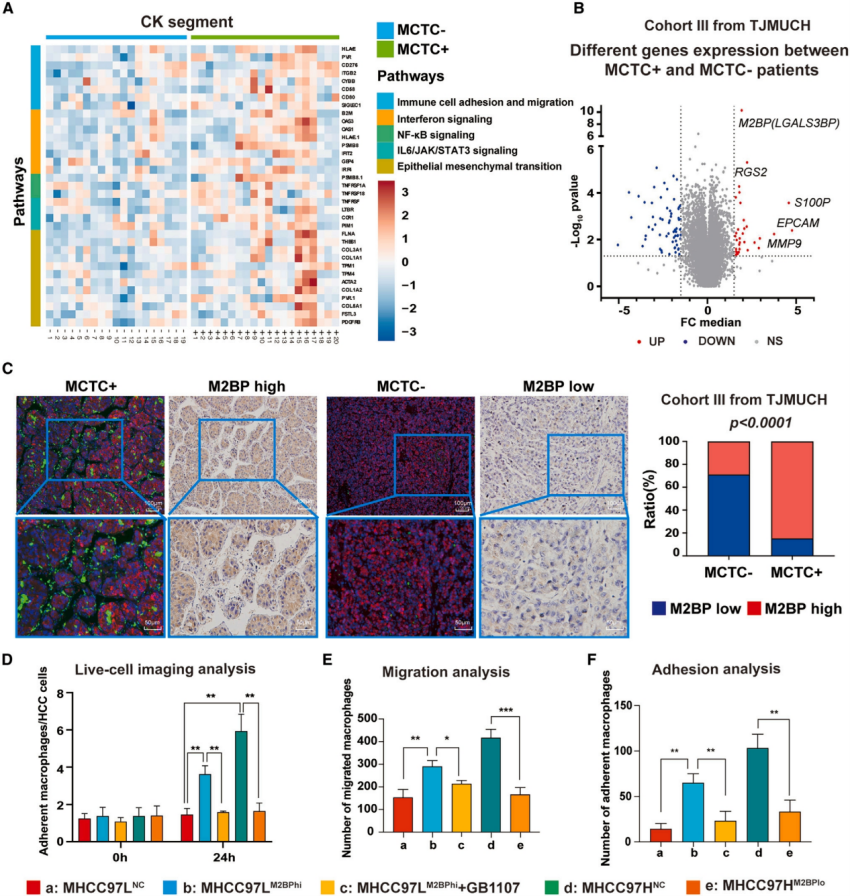
图5. 肿瘤源性M2BP诱导MCTC形成
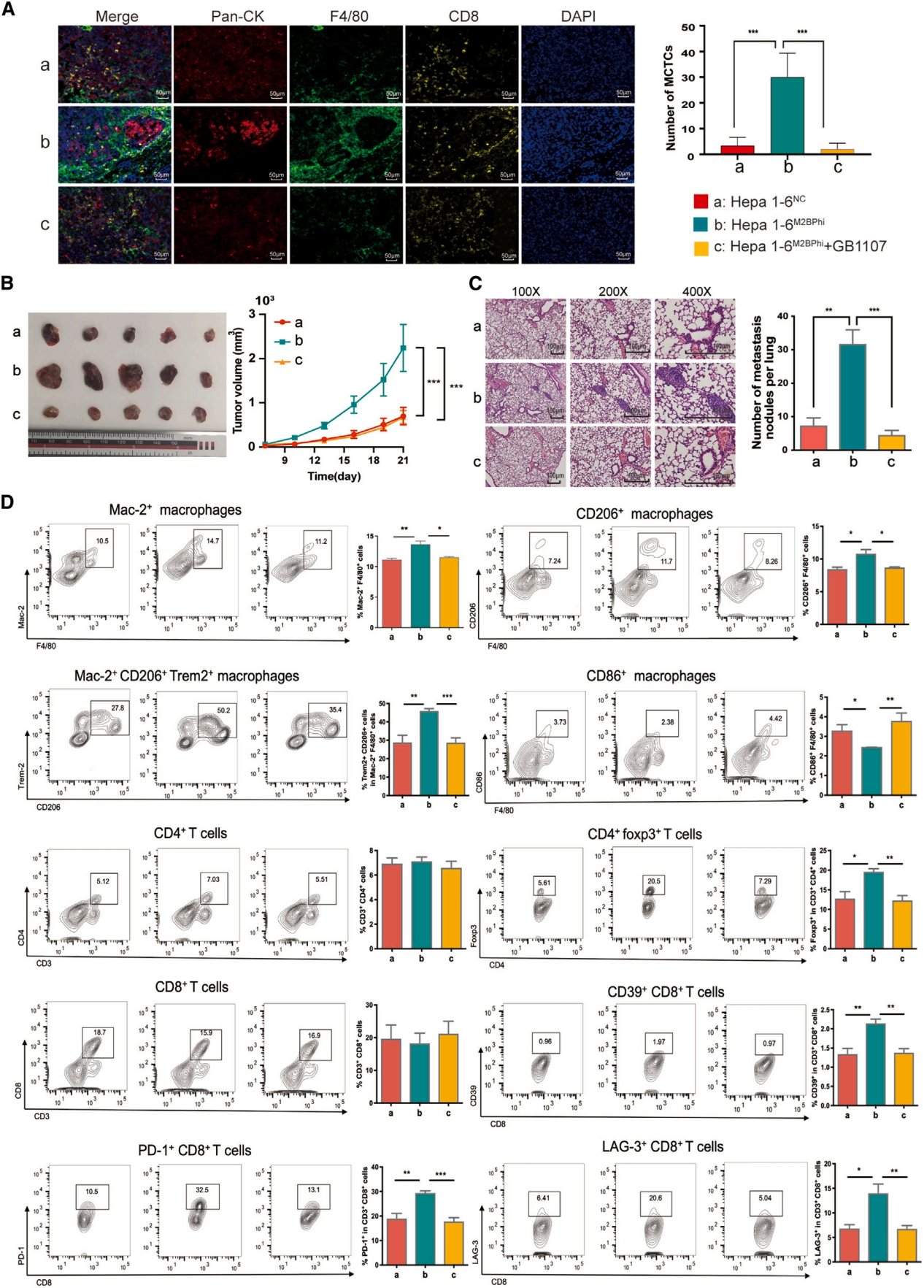
图6. 肿瘤源性M2BP诱导MCTC形成在体内的验证
6. 抗PD-1抗体与GB1107联合治疗显著抑制MCTC+ HCC的体内生长和转移
确定GB1107干预可以增加抗肿瘤免疫后,作者在植入Hepa1-6M2BPhi细胞的小鼠模型上评估了抗PD-1抗体与GB1107联合治疗MCTC+ HCC的效果。结果表明,在MCTC形成后给予抗PD-1抗体对肿瘤生长或转移的影响很小。相反,抗PD-1抗体的早期干预可明显减少原发肿瘤大小和肺转移结节。而抗PD-1抗体与GB1107联合治疗不仅明显阻碍了MCTC的形成,而且恢复了T细胞瘤内浸润,克服了局部免疫剥夺。因此,这两者的协同作用可显著减缓HCC的进展和转移,是一种很有前景的HCC治疗策略。
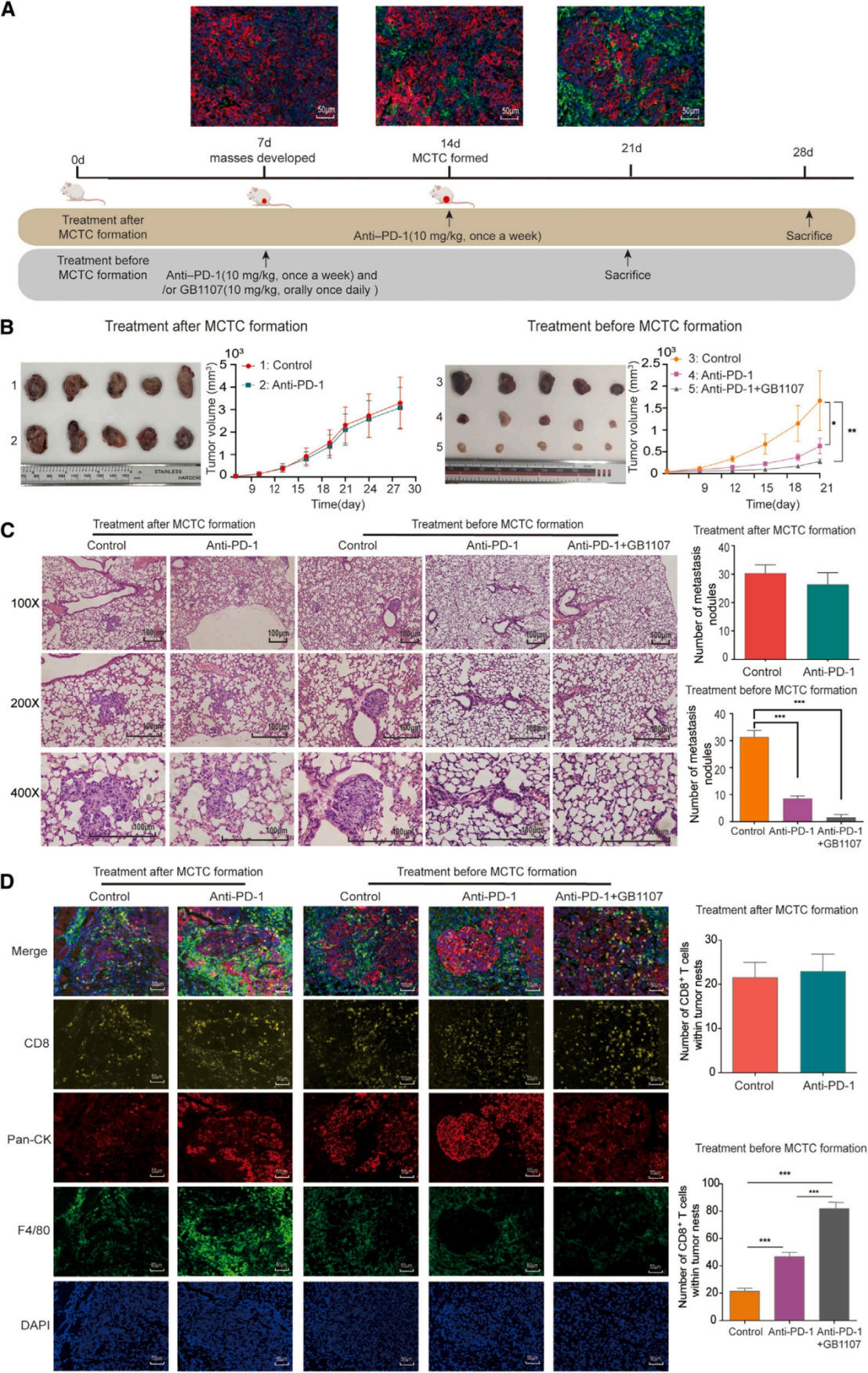
图7. 抗PD -1抗体与GB1107联合治疗显著抑制MCTC+ HCC的体内生长和转移
综上所述,作者发现了一种隔离细胞毒性T细胞和建立免疫抑制生态位的MCTC结构,该结构具备作为预后不良和ICI耐药标志物的潜力,基于深度学习的人工智能技术在MCTC识别中的应用也预示着临床诊断新时代的到来,通过提供有效工具来评估各种恶性肿瘤MCTC的预后和治疗意义!另外通过靶向M2BP破坏MCTC的形成,恢复T细胞浸润,可为提高ICI的治疗效果提供可行性的方案。
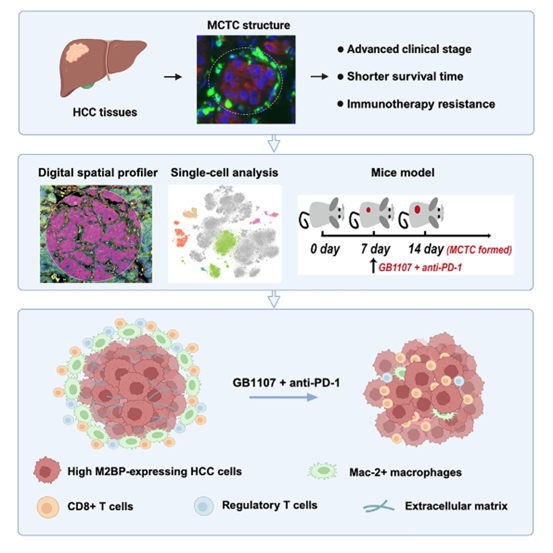
图8. 文章概要图

查看更多

查看更多

查看更多

联系我们

返回顶部